题目内容
14.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物.探究过程如下:查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
提出假设
假设l:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若假设1成立,则实验现象是固体全溶,溶液变为血红色.
(2)若假设2成立,则实验现象是有有红色固体生成,溶液变蓝,加入KSCN时,溶液不变红色.
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液不变红色,则证明假设3(填数字)成立,写出可能发生的离子方程式Fe2O3+6H+═2Fe3++3H2O、Cu2O+2H+=Cu2++Cu+H2O、2Fe3++Cu═2Fe+Cu2+.
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.实验小组欲用加热法测定Fe2O3的质量分数.取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Fe2O3的质量分数为$\frac{9(b-a)}{a}$×100%.
分析 (1)Fe3+遇到KSCN溶液呈红色;
(2)Cu2O遇到酸生成Cu和硫酸铜,无Fe3+所以溶液也不变红;
(3)铜不溶于稀硫酸,所以铜只能被铁离子氧化;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
解答 解:(1)若假设1成立,Fe2O3与稀硫酸反应生成Fe3+,则实验现象为固体溶解遇到KSCN溶液呈红色,
故答案为:固体全溶,溶液变为血红色;
(2)由资料知Cu2O溶于稀硫酸生成Cu和CuSO4,铜为红色固体不溶水,铜离子的颜色为蓝色所以溶液变蓝,因溶液中无Fe3+所以滴加KSCN试剂也不变红,
故答案为:有红色固体生成,溶液变蓝,加入KSCN时,溶液不变红色;
(3)因为Cu2O溶于硫酸生成Cu和CuSO4,而H2SO4不能溶解Cu,所以混合物中必须有Fe2O3存在,使其生成的Fe3+溶解产生的Cu,若固体全部溶解,则一定存在Fe2O3和Cu2O,涉及的反应有Fe2O3+6H+═2Fe3++3H2O、Cu2O+2H+=Cu2++Cu+H2O、2Fe3++Cu═2Fe+Cu2+,
故答案为:3;Fe2O3+6H+═2Fe3++3H2O、Cu2O+2H+=Cu2++Cu+H2O、2Fe3++Cu═2Fe+Cu2+;
(4)依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数.
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO△m
288 32
m (b-a)g
m=$\frac{288(b-a)g}{32}$=9(b-a)g,
混合物中Cu2O的质量分数为$\frac{9(b-a)}{a}$×100%,
故答案为:$\frac{9(b-a)}{a}$×100%.
点评 本题考查实验的设计及物质的组成及含量的测定,为高频考点,把握题干所给给信息的应用、发生的反应及差量法计算为解答的环境,侧重分析、实验及计算能力的综合考查,题目难度不大.

(1)H2(g)和CH3CH2OH(l)的燃烧热(△H)分别为-285.8kJ•mol-1和-1365.5kJ•mol-1,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(l)+3H2O(l)△H=-349.3kJ•mol-1
(2)写出反应2CO2(g)+6H2(gC?H3CH2OH(g)+3H2O(g)的平衡常数表达式 K=$\frac{c(C{H}_{3}C{H}_{2}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$在一定压强下,测得该反应的实验数据如下表.分析表中数据回答下列问题:
| 温度 CO2转化率 $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
(3)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所1示.
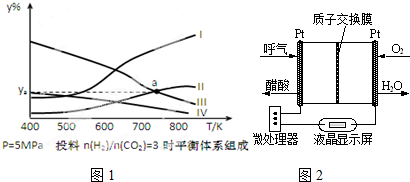
完成下列填空:
①表示CH3CH2OH体积分数曲线的是Ⅳ(选填序号)
②其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是b(选填编号);达到平衡后,能提高H2转化率的操作是ac(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
③图1中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=18.75%
(4)如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
| A. | 过量二氧化锰与浓盐酸共热反应 | |
| B. | 过量的氢气与少量氮气在一定条件下充分反应 | |
| C. | 过量铜与浓硫酸共热反应 | |
| D. | 过量氨水与硝酸银溶液反应 |
| A. | 当某可逆反应平衡向正反应方向移动时,反应物的转化率一定增加 | |
| B. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 | |
| C. | 盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变 | |
| D. | S(s)+O2(g)═SO2(g)△H3S(g)+O2(g)═SO2(g)△H4△H3<△H4 |

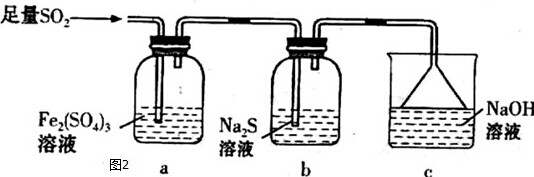
 硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题:
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂.它受热、遇酸易分解.工业上可用反应:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示.(说明:a中盛放稀硫酸;b中盛放Na2SO3固体)回答下列问题: