题目内容
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、________、________。
(2)量取反应物时,取50 mL 0.50 mol/L的盐酸,常常还需加入的试剂是________(填序号)。
A.50 mL 0.50 mol/L NaOH溶液 B.50 mL 0.55 mol/LNaOH溶液
C.55 mL 0.50mol/LNaOH溶液 D.1g固体NaOH
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两
组测定中和热的实验,实验试剂及其用量如下表所示。
反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ/mol |
A.1.0 mol/LHCl溶液50 mL、1.1 mol/L NaOH溶液50 mL | 13.0 | ΔH1 | |
B.1.0 mol/L HCl溶液50 mL、1.1 mol/L NH3·H2O溶液50 mL | 13.0 | ΔH2 |
①甲在实验之前预计ΔH1=ΔH2,他的根据可能是__________________________;乙在实验之前预计ΔH1≠ΔH2,他的根据是________________________________________________。
②实验测得的温度是:A的起始温度为13.0 ℃、终了温度为19.8 ℃;B的起始温度13.0 ℃、终了温度为19.3 ℃。设充分反应后溶液的比热容c=4.184 J/(g·℃),忽略实验仪器的比热容及溶液体积的变化,则ΔH1=_____________________ (假设溶液密度均为1 g/cm3)
【答案】 量筒 环形玻璃搅拌棒 B 生成相同量的水产生相同的热量 氨水电离需要吸收热量 -56.9kJ/mol
【解析】(1)中和热的测定实验用到的玻璃仪器有:烧杯、温度计、量筒、环形玻璃搅拌棒;(2)取50mL0.50molL-1的盐酸,为保证酸完全反应,碱稍过量,则还需加入的试剂是50mL0.55molL-1NaOH溶液,答案选B;(3)反应放出的热量Q=cm△t,在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,因此甲在实验之前预计ΔH1=ΔH2;由于氨水是弱碱,电离需要吸收热量,因此乙在实验之前预计ΔH1≠ΔH2;根据以上分析可知中和热应该按照A计算,△H1=![]() -56.9kJ/mol。
-56.9kJ/mol。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是
时间/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /rnol/L | 5.00 | 3.52 | 2.50 | 2.50 |
A. 500s内用O2表示的平均速率为1.48×10-3mol/(L-s)
B. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
C. T1温度下N2O5的平衡转化率为50%
D. 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时 c(N2O5)>5.00mol/L
【题目】某温度下的4 L密闭容器中,X、Y、W 3种气体起始状态和平衡状态时的物质的量如下表所示。下列说法正确的是
气体 | X | Y | W |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A. 此反应的平衡常数表达式为K=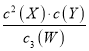
B. 达到平衡后,升高温度,W的体积分数减小,则此反应的△H>0
C. 达到平衡后,将容器体积压缩为2 L,W的物质的量浓度变为0.75mol·L-1
D. 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动

