题目内容
【题目】(18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。

③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 molL1碘的标准溶液滴定。
反应原理为:2S2O32+I2=S4O62-+2I
(5)滴定至终点时,溶液颜色的变化: 。
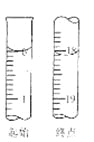
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O35H2O相对分子质量为M) 。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42,常用作脱氧剂,该反应的离子方程式为 。
【答案】(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)Na2SO4
取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4
(4)S2O32+2H+=S↓+SO2↑+H2O
(5)由无色变为蓝色
(6)18.10
![]()
(7)S2O32+4Cl2+5H2O = 2SO42+8Cl+10H+
【解析】试题分析:(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇润湿的目的是使硫粉易于分散到溶液中。
(2)根据实验装置图可知a为冷凝管;作用是冷凝回流。
(3)SO32具有还原性,能被O2氧化为SO42,所以最可能存在的无机杂质是SO42;硫酸根的检验方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4。
(4)S2O32与H+发生氧化还原反应,生成的S使产品发黄,离子方程式为:S2O32+2H+=S↓+SO2↑+H2O
(5)滴定结束后,I2使淀粉变蓝,所以滴定至终点时,溶液颜色的变化:由无色变为蓝色。
(6)根据液面示意图,滴定起始时,液面读数为0,终点液面读数为18.10ml,所以消耗碘的标准溶液体积为18.10ml;产品的纯度=0.1000mol/L×18.10×10-3L×2M÷W×100%=![]()
(7)Cl2被还原为Cl,配平可得离子方程式为:S2O32+4Cl2+5H2O = 2SO42+8Cl+10H+

 阅读快车系列答案
阅读快车系列答案