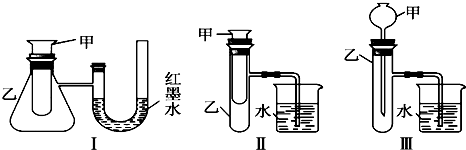
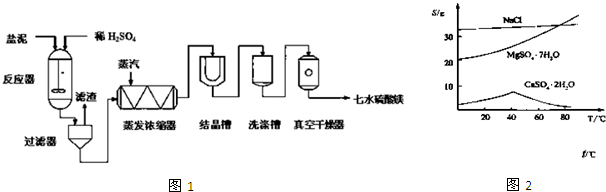
题目内容
含MnO2的质量分数为2%的KClO3、MnO2混合物,加热一段时间后测得混合物中MnO2的质量分数上升为3%,试计算KClO3的分解率?
考点:化学方程式的有关计算
专题:差量法
分析:由于反应中二氧化锰为反应的催化剂,在反应前后质量不变,因此可通过假设二氧化锰的质量而得到反应前混合物的质量、反应后固体的质量,利用质量守恒定律得出反应放出氧气的质量;由反应放出氧气质量计算分解了的氯酸钾的质量,该质量与原混合物中氯酸钾质量比即KClO3分解的质量分数.
解答:
解:设MnO2的质量为a,
则反应前混合物的质量为a÷2%=50a,其中KClO3的质量为50a-a=49a,反应后混合物的质量为a÷3%=
a,因此放出O2的质量为50a-
a=
设分解的KClO3的质量为x
2KClO3
2KCl+3O2↑
245 96
x
=
x=42.5a
KClO3分解的质量分数=
×100%=86.7%
答:KClO3分解的质量分数为86.7%.
则反应前混合物的质量为a÷2%=50a,其中KClO3的质量为50a-a=49a,反应后混合物的质量为a÷3%=
| 100 |
| 3 |
| 100 |
| 3 |
| 50a |
| 3 |
设分解的KClO3的质量为x
2KClO3
| ||
| △ |
245 96
x
| 50a |
| 3 |
| 245 |
| x |
| 96 | ||
|
x=42.5a
KClO3分解的质量分数=
| 42.5a |
| 49a |
答:KClO3分解的质量分数为86.7%.
点评:通过数据的假设,把数据不足的计算变得可行,最后把所假设的数据通过约分的数据手段而约去,这是解决复杂的计算时常采用的方法.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
以下储存物质的方法正确的是( )
| A、少量钠储存在酒精中 |
| B、氢氧化钠溶液存放在带有橡皮塞的细口瓶中 |
| C、少量硫磺存放在二硫化碳中 |
| D、液溴存放在带有橡皮塞的棕色细口瓶中 |
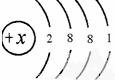 已知钾原子的原子结构示意图为:(如图所示)
已知钾原子的原子结构示意图为:(如图所示)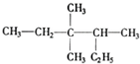
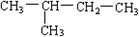 ⑧
⑧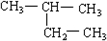
 ?2,2-二甲基丁烷.
?2,2-二甲基丁烷.