题目内容
某温度下,向2L的恒容密闭容器中,充入 1mol N2 和 3mol H2,反应到2min时达到平衡状态,平衡时有N20.8mol,填写下列空白:
(1)平衡时混合气体中三种气体的物质的量比为 ;
(2)平衡时混合气体的压强与反应前混合气体的压强之比为 ;
(3)2分钟内,NH3 的平均反应速率为 mol?L-1?min-1.
(1)平衡时混合气体中三种气体的物质的量比为
(2)平衡时混合气体的压强与反应前混合气体的压强之比为
(3)2分钟内,NH3 的平均反应速率为
考点:化学平衡的计算
专题:化学平衡专题
分析:依据化学平衡的三段式列式计算,平衡后气体压强之比等于气体物质的量之比,反应速率等于单位时间内物质浓度变化计算得到.
解答:
解:(1)依据化学平衡三段式列式计算,经过5min反应达到平衡时有10%的N2转化说明反应的浓度=4mol/L×10%=0.4mol/L;
N2 +3H2? 2NH3
2NH3
起始(mol) 1 3 0
转化(mol) 0.2 0.6 0.4
平衡(mol) 0.8 2.4 0.4
所以n( N2 ):n( H2 ):n(NH3)=0.8:2.4:0.4=2:6:1,故答案为:2:6:1;
(2)平衡时混合气体的压强与反应前混合气体的压强之比等于物质的量之比,所以平衡时混合气体的压强与反应前混合气体的压强之比=
=9:10,故答案为:9:10;
(3)2min 内NH3的平均反应速率V(NH3)=
=0.1 mol/(L?min),
故答案为:0.1;
N2 +3H2?
 2NH3
2NH3起始(mol) 1 3 0
转化(mol) 0.2 0.6 0.4
平衡(mol) 0.8 2.4 0.4
所以n( N2 ):n( H2 ):n(NH3)=0.8:2.4:0.4=2:6:1,故答案为:2:6:1;
(2)平衡时混合气体的压强与反应前混合气体的压强之比等于物质的量之比,所以平衡时混合气体的压强与反应前混合气体的压强之比=
| 0.8+2.4+0.4 |
| 1+3 |
(3)2min 内NH3的平均反应速率V(NH3)=
| ||
| 2min |
故答案为:0.1;
点评:本题主要考查了根据化学反应进行化学平衡的计算,难度不大,解题时注意基本方法和基础知识的运用.

练习册系列答案
相关题目
以下分子(或离子)①CH4;②NH4+;③CH2Cl2;④P4;⑤CO2;⑥CCl4;⑦H3O+,其结构为正四面体,且键角为109°28′的是( )
| A、①②⑥ | B、①④⑥ |
| C、①③⑥ | D、①②③④⑥ |
根据相似相溶的一般规律,若要溶解NaCl应选用( )
| A、水 |
| B、CCl4 |
| C、酒精 |
| D、汽油(非极性分子) |
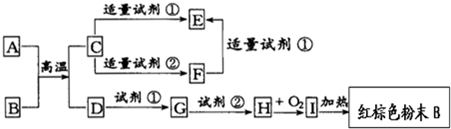
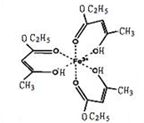 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.