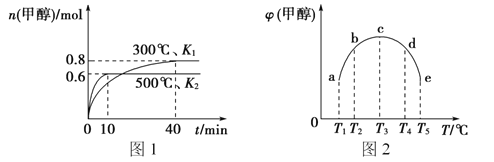
题目内容
【题目】(题文)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
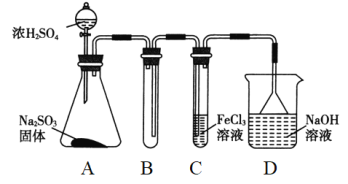
(1)通入足量SO2时C中观察到的现象是______________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:_______________________;
②请设计实验方案检验有Fe2+生成:_________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_____(填“合理”或“不合理”),理由是______。
(3)D装置中倒置漏斗的作用是__________________________。
(4)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液
【答案】溶液由棕黄色变为浅绿色2Fe3++SO2+2H2O===SO42-+4H++2Fe2+取C中反应后的溶液,向其中滴人KSCN溶液,不变红,再加入新制的氯水,溶液变红不合理硝酸可以将溶解的SO2氧化为H2SO4,干扰实验防止溶液倒吸bc
【解析】
装置A中的分液漏斗中的浓硫酸滴入锥形瓶中反应生成二氧化硫气体,通过装置B为安全瓶,通过装置C中的氯化铁溶液具有氧化性能氧化二氧化硫为硫酸,氯化铁被还原为氯化亚铁,最后过量的二氧化硫被氢氧化钠溶液吸收,据此判断。
(1)通入足量SO2时C中发生二氧化硫与氯化铁的氧化还原反应,生成硫酸亚铁,则观察到溶液由棕黄色变为浅绿色;
(2)①二者发生氧化还原反应,生成硫酸根离子、亚铁离子,离子反应方程式为2Fe3++SO2+2H2O=SO42-+4H++2Fe2+;
②亚铁离子易被氧化为铁离子,可以用KSCN溶液检验铁离子,则检验有Fe2+生成的实验方法为取C中反应后的溶液,向其中滴入KSCN溶液,不变红,再加入新制的氯水,溶液变红;
③由于硝酸具有强氧化性,则硝酸可以将溶解的SO2氧化为硫酸,干扰试验,所以做法不合理;
(3)因尾气易溶于NaOH溶液,则倒置漏斗的作用为防止NaOH溶液倒吸;
(4)验证SO2具有还原性,可与高锰酸钾或碘水发生氧化还原反应,S元素的化合价升高,而与浓硫酸、NaCl不反应,答案为b、c。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
(1)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为______________(填序号)。
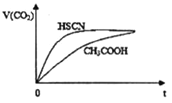
(2)25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示,反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是________。反应结束后所得两溶液中,c(CH3COO-)____c(SCN-)(填“>”、“<”或“=")。
(3)若保持温度不变,在醋酸溶液中加少量盐酸,下列量会变小的是___(填序号)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数