题目内容
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为1.5NA
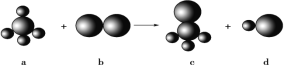
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图,其中Si原子的杂化方式与图中S8单质中S原子的杂化方式相同


【答案】D
【解析】
A. BF3为平面三角形,键角为120°,CH4为正四面体,键角为109°28′,NH3
为三角锥形,键角为107°,H2O是V型,键角为104.5°,所以键角为:BF3>CH4>NH3>H2O,故A错误;
B. CO2含有碳氧双键,所以分子中含有σ键和π键,HCHO 的结构式中含有C-H、碳氧双键,其分子中有σ键和π键,而HClO中只存在共价单键,只存在σ键,故B错误;
C.1mol氮气分子中含有2molπ键,若该反应中有4 mol N—H键断裂,即有1mol N2H4参加反应,生成1.5mol氮气,所以形成的π键有3mol,故C错误;
D. 硅酸盐中的硅酸根(SiO44-) 为正四面体结构,所以中心原子Si原子采取了sp3杂化方式; S8单质中S原子有2对孤电子对和2个σ键,杂化方式也是sp3,故D正确。
故选D。

【题目】某温度下,CO(g) + H2O (g)![]() CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
CO2(g)+ H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g) 和 H2O (g)的起始浓度及5min时的浓度如下表所示。
甲 | 乙 | |||
起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
下列判断不正确的是
A.x = y = 0.16
B.反应开始时,乙中反应速率比甲快
C.甲中0~5min的平均反应速率: v(CO)=0.004"mol/(L·min)
D.平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍
【题目】一定条件下,密闭可变容器中发生可逆反应N2+3H2![]() 2NH3能说明反应已达到平衡状态的是
2NH3能说明反应已达到平衡状态的是
A.以上三种物质的浓度相等B.压强恒定
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:
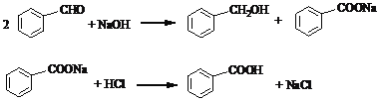
副反应:
![]()
主要物料的物理常数如下表:
名称 | 分子量 | 性状 | 相对密度 (g·cm-3) | 沸点 (℃) | 溶解度 | ||
水 | 乙醚 | ||||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
乙醚 | 74 | 无色液体。 | 0.71 | 35 | 不溶 | -- | |
实验步骤:
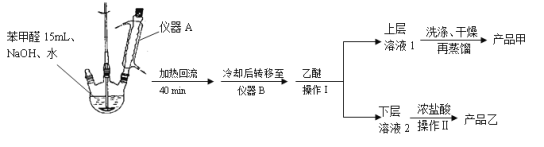
(1)仪器A的作用是_______________。
(2)蒸馏操作时温度应该控制在___________左右。获得产品乙时进行的操作Ⅱ的名称是__________________。
(3)①上层溶液1中除乙醚外主要有机杂质是____________、_____________。
洗涤时先后用到了饱和NaHSO3 溶液、10%的NaHCO3溶液和水。
②洗涤操作在______________中进行。
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至___________________(填现象)时说明杂质已被除尽。
(4)若产品甲的质量为5.40 g,则产品甲的产率是_____________________。