题目内容
【题目】已知图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)请回答下列问题:
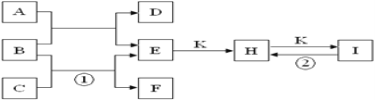
(1)物质A的化学式为____________________。
(2)反应①的离子方程式为_________________________________________。
(3)反应②的化学方程式为__________________________________________。
(4)加热10g H和I的混合物质至质量不再变化,剩余固体质量8.45g,原混合物中H的质量分数为________________。
【答案】Na2O2 2Na+2H2O=2Na++2OH-+H2↑ 2NaHCO3![]() Na2CO3+CO2↑+H2O 58%
Na2CO3+CO2↑+H2O 58%
【解析】
由题干信息分析可知,A是由单质C在D中燃烧生成的淡黄色固体,A是过氧化钠,C是钠,D是氧气。温常压下,D、F、K均为无色无刺激性气味的气体。B是最常见的无色液体,B是水,水和过氧化钠反应生成氧气和氢氧化钠,则E是氢氧化钠。钠和水反应生成氢氧化钠和氢气,则F是氢气。H和I焰色反应均为黄色,则K是二氧化碳,H是碳酸钠,I是碳酸氢钠,碳酸氢钠分解可以生成碳酸钠,据此分析解答问题。
(1)由上述分析可知,A是过氧化钠,化学式为Na2O2,故答案为:Na2O2;
(2)反应①为Na与水反应生成NaOH和H2,反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑,故答案为:2Na+2H2O===2Na++2OH-+H2↑;
(3)反应②为NaHCO3受热分解变成Na2CO3、H2O和CO2,反应方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O,故答案为:2NaHCO3
Na2CO3+CO2↑+H2O,故答案为:2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)加热碳酸钠和碳酸氢钠的混合物时,碳酸钠不分解,碳酸氢钠不稳定,加热时分解生成碳酸钠、二氧化碳和水,发生反应为2NaHCO3![]() Na2CO3+CO2↑+H2O,则固体质量减少的原因是由于碳酸氢钠分解的缘故,剩余固体是Na2CO3;
Na2CO3+CO2↑+H2O,则固体质量减少的原因是由于碳酸氢钠分解的缘故,剩余固体是Na2CO3;
设混合物中碳酸氢钠的质量为m,利用差量法计算,则:
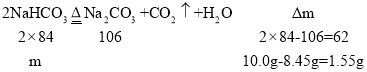
![]()
所以混合物中碳酸钠的质量为10.0g4.2g=5.8g,混合物中碳酸钠的质量分数为:![]() ,故答案为:58%。
,故答案为:58%。