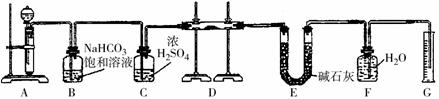
题目内容
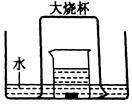
(1)实验过程中,观察到的主要现象是:
①铜片表面产生气泡,铜片变小并逐渐消失;;
②小烧杯中溶液的颜色逐渐变成蓝绿色;
③________________________________________________;
④ 大烧杯内液面略有上升,水槽中液面略有下降。
(2)欲使反应现象更明显,应向小烧杯中加入__________。
A、粗铜片 B、纯铜片
(3)用该装置做铜与浓硝酸反应的实验,最突出的优点是:
_________________________________________________________________________。
(4)若要验证最终得到的气体生成物,最简便的方法是:
_________________________________________________________________________。
(5)工业上吸收NO和NO2的混合气体,常使用NaOH溶液(知NO + NO2 +2NaOH==2NaNO2+H2O)。欲使NO和NO2被充分吸收,则NO和NO2的体积应满足_______。
A.V(NO)>V(NO2) B、V(NO)<V(NO2) C、V(NO)≤V(NO2)
(1)③烧杯中有红棕色气体生成,一段时间后气体颜色又逐渐褪去(2分)
(2)A(1分)
(3)该装置最主要的优点是:反应体系封闭,无氮氧化合物逸出,不污染环境。(2分)
(4)轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体。(2分)
(5)C(2分)
(2)A(1分)
(3)该装置最主要的优点是:反应体系封闭,无氮氧化合物逸出,不污染环境。(2分)
(4)轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体。(2分)
(5)C(2分)
本题重点是考查Cu与浓HNO3反应的实验。(1)该题将铜与浓硝酸反应的实验放置于新的情境中,除要掌握基本的铜与浓硝酸反应前后铜片的变化、溶液颜色的变化,气体颜色的描述,还要注意生成的NO2要与水反应产生NO,则随后气体颜色变浅,大烧杯内压强减小,则水面略有上升,水槽中的水面将稍有下降;(2)为使反应速率加快,则可用粗铜,形成原电池;(3)因Cu与浓HNO3反应生成的NO2和间接得到的NO,都是污染性气体,必须有尾气吸收装置,对比传统实验,所以该装置最突出的优点是:没有尾气处理装置,却无氮氧化合物逸出,不污染环境;(4)验证NO气体存在的简单方法就是让其接触空气,观察气体颜色的变化,所以可轻轻掀起倒扣的大烧杯,放入适量的空气,观察是否有红棕色气体生成。(5)因2NO2+2NaOH=NaNO3+NaNO2+H2O,NO + NO2 +2NaOH==2NaNO2+H2O,观察两个方程式,则只要NO2气体比NO多,则混合气体就能够被NaOH溶液完全吸收,所以V(NO2) :V(NO)≥1,答案为C

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 CuSO4。②由Cu
CuSO4。②由Cu CuSO4,试回答:
CuSO4,试回答: