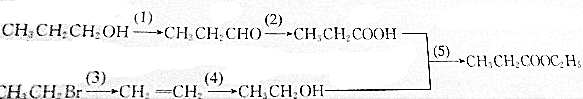题目内容
13.向27.2gCu和Cu2O的混合物中加入2mo1/L的稀硝酸0.6L,固体物质完全反应,生成NO和Cu(NO3)2. 在所得溶液中加入2.0mol/L的Na0H溶液,此时溶液呈中性,金属离子完全沉淀,沉淀质量为39.2g,下列有关说法正确的是( )| A. | 消耗NaOH溶液的体积为0.5L | |
| B. | 产生气体的体积一定是4.48L | |
| C. | Cu、Cu2O与硝酸反应后剩余为0.5mol | |
| D. | Cu、Cu2O的物质的量之比是1:2 |
分析 在所得溶液中加入NaOH溶液后,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,沉淀为Cu(OH)2,质量为39.2g,物质的量为$\frac{39.2g}{98g/mol}$=0.4mol,根据铜原子守恒,反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=27.2,根据铜元素守恒有x+2y=0.4,联立方程解得x=0.2,y=0.1.
A.利用电子转移守恒计算n(NO),根据N元素守恒可知:n原(HNO3)=n(NO)+n(NaNO3),根据Na元素可知n(NaNO3)=n(NaOH),再根据V=$\frac{n}{c}$计算需要NaOH溶液体积;
B.NO不一定处于标况下;
C.根据N元素守恒,可知n剩余(HNO3)+2n[[Cu(NO3)2]=n(NaNO3);
D.根据分析可知Cu、Cu2O的物质的量之比.
解答 解:在所得溶液中加入NaOH溶液后,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,沉淀为Cu(OH)2,质量为39.2g,物质的量为$\frac{39.2g}{98g/mol}$=0.4mol,根据铜原子守恒,反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],设Cu和Cu2O的物质的量分别为xmol、ymol,根据二者质量有 64x+144y=27.2,根据铜元素守恒有x+2y=0.4,联立方程解得x=0.2,y=0.1.
A.根据电子转移守恒可知:3n(NO)=2n(Cu)+2n(Cu2O),所以3n(NO)=2×0.2mol+2×0.1mol,解得n(NO)=0.2mol,根据N元素守恒可知n原(HNO3)=n(NO)+n(NaNO3)=0.2mol+n(NaNO3)=2mol/L×0.6L=1.2mol,所以n(NaNO3)=1mol,根据Na元素可知n(NaOH)=n(NaNO3)=1mol,需要NaOH溶液体积为$\frac{1mol}{2mol/L}$=0.5L,故A正确;
B.生成的NO为0.2mol,但不一定是标况下,其体积不一定为4.48L,故B错误;
C.反应后的溶液中加入氢氧化钠溶液,氢氧化钠与硝酸铜反应,剩余的氢氧化钠与硝酸反应,最后为硝酸钠溶液,根据氮元素守恒可知反应后溶液中n(HNO3)+2n[[Cu(NO3)2]=n(NaNO3),所以n(HNO3)=n(NaNO3)-2n[[Cu(NO3)2]=1mol-2×0.4mol=0.2mol,故C错误;
D.由上述分析可知,n(Cu):n(Cu2O)=0.2mol:0.1mol=2:1,故D错误,
故选:A.
点评 本题考查混合物计算、氧化还原反应的计算,需要学生清楚反应过程,充分利用守恒思想进行解答,较好的考查学生分析计算能力,B选项为易错点,学生容易忽略NO不一定是标况下.

 高中必刷题系列答案
高中必刷题系列答案| A. | 金属焊接时可用NH4Cl溶液作除锈剂 | |
| B. | 配制FeSO4溶液时,加入一定量Fe粉 | |
| C. | 长期施用铵态氮肥会使土壤酸化 | |
| D. | 向FeCl3溶液中加入CaCO3粉末后有气泡产生 |
| A. | 原子半径:Z>Y>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
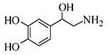
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多与2mol Br2发生取代反应 | |
| D. | 去甲肾上腺素既能与碳酸氢钠反应生成二氧化碳气体,又能与盐酸反应 |
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 纯碱溶液呈碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4-+Ba2++2OH-═BaSO4↓+SO42-+2H2O | |
| D. | 氢氧化铜溶于氢溴酸:Cu(OH)2+2H+═Cu2++2H2O |
| A. | Na2CO3 | B. | HCl | C. | H2O | D. | NaOH |