题目内容
8.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图1,然后回答问题.
(1)图中所示反应是放热(填“吸热”或“放热”)反应.
(2)已知拆开1mol H-H键、1mol I-I、1mol H-I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由1mol氢气和1mol 碘反应生成HI会放出(填“放出”或“吸收”)11kJ的热量.在化学反应过程中,是将化学能转化为热能.
(3)某实验小组同学进行如图2的实验,以探究化学反应中的能量变化.
(1)实验表明:①中的温度降低,由此判断氢氧化钡晶体与氯化铵晶体反应是吸热(填“吸热”或“放热”)反应.
(2)实验②中,该小组同学在烧杯中加入5mL 1.0mol/L盐酸,再放入用砂纸打磨过的铝条,该反应是放热(填“吸热”或“放热”)反应.
分析 (1)反应物的能量大于生成物的能量,反应为放热反应,反之为吸热反应;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:(1)依据图象分析反应物的能量大于生成物的能量,反应为放热反应;
故答案为:放热;
(2)在反应H2+I2?2HI中,断裂1molH-H键,1molI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2molHI,共形成2molH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ,化学能转化为热能;
故答案为:放出;11;化学能;热能;
(3)氢氧化钡晶体与氯化铵晶体反应是吸热反应;铝条与盐酸反应是放热反应;
故答案为:吸热;放热;
点评 本题主要考查焓变的求算,△H=生成物能量-反应物能量=反应物键能和-生成物键能和,以及化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.对于下列化学问题的表述不正确的是( )
| A. | 为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 | |
| B. | 11H、21H、31H是三种不同核素,互称为同位素,都属于氢元素 | |
| C. | X、Y两种元素的简单离子具有相同的电子层结构,则核电荷数大的元素离子半径小 | |
| D. | 18O中质子数与中子数不相等,但其和为18 |
3.甲、乙两种非金属:①甲比乙容易与氢气化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低.能说明甲比乙的非金属性强的是( )
| A. | 只有④ | B. | 只有⑤ | C. | ①②③ | D. | ①②③④⑤ |
13.随着卤素原子序数的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 卤素原子半径逐浙减少 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐减弱 |
20.同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判断正确的是( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱.
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
17.某温度下,对可逆反应2X(g)+Y(g)?3Z(g)+W(s)△H>0 的叙述正确的是( )
| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 加压,正反应速率增大,逆反应速率减小 | |
| C. | 温度、体积不变,充入He气加压,反应速率加快 | |
| D. | 升温,混合气平均相对分子质量减小 |
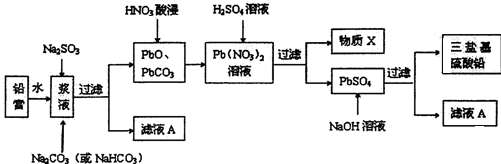

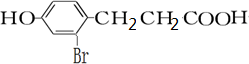 .
.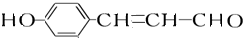 +2[Ag(NH3)2]OH
+2[Ag(NH3)2]OH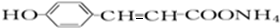 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.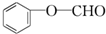 ,
,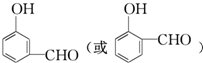 .
. +2nH2O.
+2nH2O.