题目内容
5.现有硫酸和硝酸的浓度分别为4mol/L和2mol/L的混合液,取混合液100mL加入过量铁粉,若硝酸的还原产物为NO,则生成一氧化氮和氢气在标准状况下的体积各为多少升?消耗铁粉的质量为多少?分析 硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,根据n=cV计算H2SO4、HNO3物质的量,根据N元素守恒可知n(NO)=n(HNO3),根据硫酸根守恒可知n(FeSO4)=n(H2SO4),根据Fe元素守恒计算参加反应Fe的物质的量,再根据电子转移守恒计算氢气物质的量,根据V=nVm计算NO、氢气体积.
解答 解:硫酸、硝酸的混合溶液与过量的Fe反应生成NO、氢气,说明硝酸完全被还原生成NO,最终得到FeSO4溶液,
根据N元素守恒可知n(NO)=n(HNO3)=0.1L×2mol/L=0.2mol,故生成NO的体积=0.2mol×22.4L/mol=4.48L;
根据硫酸根守恒可知n(FeSO4)=n(H2SO4)=0.1L×4mol/L=0.4mol,根据Fe元素守恒,参加反应Fe的物质的量=n(FeSO4)=0.4mol,质量为0.4mol×56g/mol=22.4g,令生成氢气为x mol,根据电子转移守恒:2x+0.2×(5-2)=0.4×2,解得x=0.1,故生成氢气的体积=0.1mol×22.4L/mol=2.24L;
答:标况下,生成一氧化氮的体积为4.48L,生成氢气的体积为2.24L;消耗铁的质量为22.4g.
点评 本题考查混合物计算,判断发生的反应是解题关键,侧重对解题方法技巧与思维能力的考查,注意利用守恒思想进行解答,难度中等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
15.甲醇和氧气以及强碱作电解质溶液新型手机电池,电量可达到现在用镍氢或锂电池的十倍,可连续使用一个月才充一次电.该电池反应的离子方程式是:2CH3OH+3O2+4OH-═2CO32-+6H2O.据此判断下列说法正确( )
| A. | CH3OH在负极上失去电子,O2在正极上得到电子 | |
| B. | 溶液中OH-向正极移动,H+向负极移动 | |
| C. | CH3OH发生还原反应,O2发生氧化反应 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH值基本保持不变 |
13.下列说法中正确的是( )
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由正极流向负极 | |
| C. | 在电解池中,物质在阴极发生氧化反应 | |
| D. | 在电解池中,与电源正极相连的电极是阴极 |
20.下列关于有机化合物的认识不正确的是( )
| A. | 油脂在空气中完全燃烧转化为水和二氧化碳 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 | |
| C. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ | |
| D. | 医学上了利用银镜反应来检验患者尿液中葡萄糖含量是否偏高 |
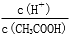 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。 2AB2(g)△H<0,下列说法正确的是( )
2AB2(g)△H<0,下列说法正确的是( ) 2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L、0.08mol/L,则下列判断正确的是( )

 ,
,