题目内容
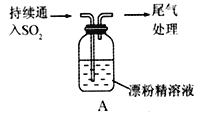
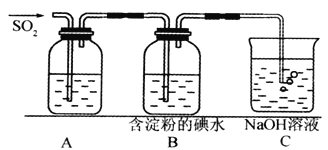
【题目】(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置A中的现象是__________________,写出B中发生反应的离子方程式:__________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。
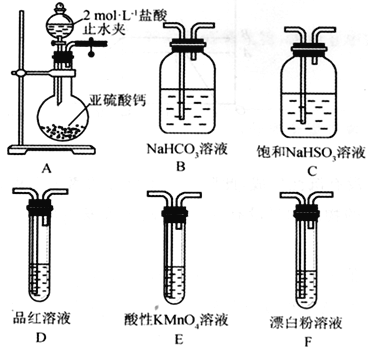
(4)装置正确的连接顺序为A、________________________________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_____________________________。
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是______________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_________________________________。
【答案】 b 溶液由黄色逐渐变为浅绿色 I2+SO2+2H2O=2I-+SO42-+4H+ ① C B E 制取CO2 D中品红溶液不褪色,F中出现白色沉淀 2Cl2+2Ca(OH)2==CaCl2 + Ca(CIO)2+2H2O 碱性、漂白性 ClO-+Cl-+2H+=H2O+Cl2↑
【解析】本题考查实验方案设计与评价,(I)(1)从FeCl3溶液中得到FeCl3晶体,为防止Fe3+水解,在加热时,需要在HCl的氛围中加热FeCl3溶液,得到FeCl3晶体,然后过滤,因此使用不到的仪器是烧瓶;(2)A中盛放含有Fe3+的溶液,利用Fe3+的氧化性把SO2氧化成SO42-,本身被还原成Fe2+,即溶液的颜色由棕黄色变为浅绿色;I2具有氧化性,能把SO2氧化成SO42-,本身被还原成I-,离子反应方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;(3)方案①:因为通入过量的SO2,加入KMnO4溶液后,紫红色褪去,不能说明SO2与Fe3+发生氧化还原反应,故方案①不合理;方案②:加入KSCN溶液,溶液不变红,说明溶液中不含Fe3+,再加入氯水,溶液变红,说明溶液中含有Fe3+,从而推出SO2与Fe3+发生氧化还原反应,Fe3+被还原成Fe2+,故方案②合理;(II)(4)根据题目所给装置,先比较亚硫酸与碳酸酸性,然后利用碳酸的酸性强于次氯酸,从而作出推断,装置A作用是制取SO2,此装置中SO2含有HCl,HCl干扰实验,必须除去,制出的SO2通入到C装置,然后通入到装置B中,有气泡冒出,说明亚硫酸的酸性强于碳酸,此气体中混有SO2,然后用KMnO4溶液除去SO2,然后再通入品红溶液,检验SO2是否被完全除尽,品红不褪色,说明SO2被完全除尽,通入到F装置中,如果有白色沉淀产生,说明碳酸酸性强于次氯酸,从而得出结论,因此装置的连接顺序是A→C→B→E→D→F,装置B的作用是制取CO2,现象是D中品红溶液不褪色,F中出现白色沉淀;(III)(5)发生的反应是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;(6)pH试纸先变蓝,说明溶液显碱性,后褪色,说明溶液具有漂白性或强氧化性;(7)ClO-中Cl显+1价,Cl-显-1价,在酸性条件下发生:ClO-+Cl-+2H+=H2O+Cl2↑。

【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钠溶液的体积 | 盐酸的体积 | 溶液的pH |
① | 20.00 | 0.00 | 10 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A. 1 B. 4 C. 2 D. 6