题目内容
【题目】下列日常生活用品中,所使用的主要材料属于合成纤维的是( )
A. 纯棉服装 B. 蚕丝被 C. 尼龙绳 D. 羊毛衫
【答案】C
【解析】A、棉花的成分是纤维素,属于天然纤维,故A错误;B、蚕丝的成分是蛋白质,是天然有机高分子材料,故B错误;C、尼龙属于合成纤维,故C正确;D、羊毛衫的材料是羊绒,成分是蛋白质,属于天然有机高分子材料,故D错误。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液:2Cl-+2H2O | 用惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性:H++OH-=H2O |
A. A B. B C. C D. D
【题目】(I)SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2,可以使用的药品和装置如下图所示:
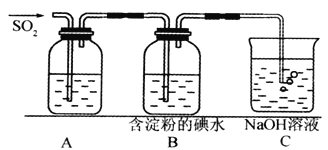
(1)若要从FeCl3溶液中提取晶体,在必须进行的实验操作步骤中,没有用到的玻璃仪器有________________(填字母)。
a.酒精灯 b.烧瓶 c.漏斗 d.烧杯 e.玻璃棒
(2)装置A中的现象是__________________,写出B中发生反应的离子方程式:__________________。
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下试验
方案①:向第一份溶液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案中不合理的是_______________(填序号)。
(Ⅱ)SO2溶于水生成亚硫酸,亚硫酸的酸性强于次氯酸。选择下面的装置和药品来探究亚硫酸与次氯酸的酸性强弱。
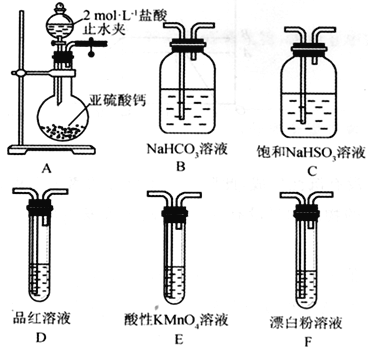
(4)装置正确的连接顺序为A、________________________________、D、F,其中装置B的作用是_________。证明亚硫酸的酸性强于次氯酸的现象为_____________________________。
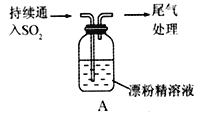
(Ⅲ)某同学对SO2与漂粉精的反应进行了实验探究。
操作 | 现象 |
取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| ①溶液出现浑浊,并变为黄绿色 ②稍后,产生大量白色沉淀,黄绿色褪去 |
(5)C12和Ca(OH)2反应制取漂粉精的化学方程式是______________________________________。
(6)pH试纸颜色的变化说明漂粉精溶液具有的性质是__________________________________。
(7)现象①中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分ClO-和Cl-发生反应。写出漂粉精在酸性条件下发生反应的离子方程式:_________________________________。