题目内容
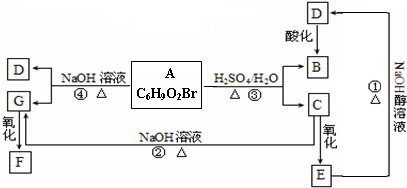
已知:A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料.如图所示,是几种物质的转化关系图:
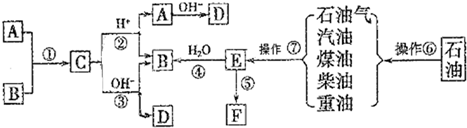
(1)操作⑦的名称为: ,上述反应中属于取代反应的是 (填序号).
(2)写出比B多两个碳原子,且不能发生去氢反应的同系物的结构简式: .
(3)写出反应③的离子方程式 .
(4)若120g A和184g B反应生成106g C,则该反应的产率为 .
(5)由E为主要原料合成的一种分子式为C4H4O4的环酯,写出这种酯的结构简式和名称 .

(1)操作⑦的名称为:
(2)写出比B多两个碳原子,且不能发生去氢反应的同系物的结构简式:
(3)写出反应③的离子方程式
(4)若120g A和184g B反应生成106g C,则该反应的产率为
(5)由E为主要原料合成的一种分子式为C4H4O4的环酯,写出这种酯的结构简式和名称
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,则E为CH2=CH2,E通过加聚反应得到常见的高分子材料F,则F为聚乙烯;E与水发生加成反应生成B为C2H5OH,A与B反应生成C,C能在酸或碱条件下水解生成A、B、D,则A为CH3COOH,C为CH3COOCH2CH3,D为CH3COONa,以此来解答.
解答:
解:A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,则E为CH2=CH2,E通过加聚反应得到常见的高分子材料F,则F为聚乙烯;E与水发生加成反应生成B为C2H5OH,A与B反应生成C,C能在酸或碱条件下水解生成A、B、D,则A为CH3COOH,C为CH3COOCH2CH3,D为CH3COONa,
(1)操作⑦是将长链烃转化为乙烯,应是裂解,由上述反应①②③属于取代反应,
故答案为:裂解;①②③;
(2)比C2H5OH多两个碳原子,且不能发生去氢反应的同系物的结构简式: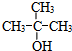 ,
,
故答案为: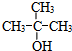 ;
;
(3)反应③的离子方程式为:CH3COOCH2CH3+OH-→CH3CH2OH+CH3COO-,
故答案为:CH3COOCH2CH3+OH-→CH3CH2OH+CH3COO-;
(4)120g A和184g B反应,由反应CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,可知乙醇过量,理论上可以生成乙酸乙酯的质量为:120g×
=176g,而实际生成得到106g 乙酸乙酯,则该反应的产率为 为
×100%=60.2%,
故答案为:60.2%;
(5)由乙烯为主要原料合成的一种分子式为C4H4O4的环酯,应是乙二酸与乙二醇反应生成乙二酸乙二酯,结构简式为: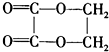 ,
,
故答案为: ;乙二酸乙二酯.
;乙二酸乙二酯.
(1)操作⑦是将长链烃转化为乙烯,应是裂解,由上述反应①②③属于取代反应,
故答案为:裂解;①②③;
(2)比C2H5OH多两个碳原子,且不能发生去氢反应的同系物的结构简式:
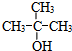 ,
,故答案为:
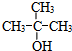 ;
;(3)反应③的离子方程式为:CH3COOCH2CH3+OH-→CH3CH2OH+CH3COO-,
故答案为:CH3COOCH2CH3+OH-→CH3CH2OH+CH3COO-;
(4)120g A和184g B反应,由反应CH3CH2OH+CH3COOH
| 浓硫酸 |
| △ |
| 88 |
| 60 |
| 106g |
| 176g |
故答案为:60.2%;
(5)由乙烯为主要原料合成的一种分子式为C4H4O4的环酯,应是乙二酸与乙二醇反应生成乙二酸乙二酯,结构简式为:
 ,
,故答案为:
 ;乙二酸乙二酯.
;乙二酸乙二酯.
点评:本题考查有机物的推断,E为乙烯是解答本题的突破口,再根据各物质之间的转化推出各物质,题目难度中等.

练习册系列答案
相关题目
在下列变化中,只发生物理变化的是( )
| A、空气液化制取氮气 |
| B、酸雨侵蚀建筑物 |
| C、荔枝酿酒 |
| D、生石灰遇水成为熟石灰 |
下列过程或事实涉及氧化还原反应的是( )
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
①蔗糖炭化 ②用氢氟酸雕刻玻璃 ③铁遇冷的浓硫酸钝化 ④装碱液的试剂瓶不用玻璃塞 ⑤雷雨发庄稼 ⑥实际使用的浓硝酸显黄色.
| A、①③⑤⑥ | B、②④ |
| C、②③④⑥ | D、①②③④⑤⑥ |



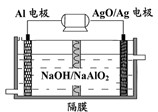 铝是日常生活中用途最多的金属元素,如图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝做
铝是日常生活中用途最多的金属元素,如图为Al-AgO电池的构造简图,电解质溶液为NaOH,它可用作水下动力电源,该电池中铝做