题目内容
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1;
CH3OH(g)═CH3OH(l)△H=-b kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJ?mol-1;
H2O(g)═H2O(l)△H=-d kJ?mol-1,则表示CH3OH(l)燃烧热的热化学方程式为: .
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.

①能说明该反应已达平衡状态的是 .
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时问内每消耗1.2mol H2,同时生成0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②从0min到10min,v(H2)= .
③下列措施中能使
增大的是 (选填编号).
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2mol CO2和3mol H2
④计算该温度下此反应的平衡常数K= .若改变 条件(填选项),可使K=1.
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图2所示
①则M区发生的电极反应式为 .
②用上述电池做电源,用图3装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为: .假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为 (忽略溶液体积变化).
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1;
CH3OH(g)═CH3OH(l)△H=-b kJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJ?mol-1;
H2O(g)═H2O(l)△H=-d kJ?mol-1,则表示CH3OH(l)燃烧热的热化学方程式为:
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图1所示.

①能说明该反应已达平衡状态的是
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时问内每消耗1.2mol H2,同时生成0.4mol H2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②从0min到10min,v(H2)=
③下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2mol CO2和3mol H2
④计算该温度下此反应的平衡常数K=
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图2所示
①则M区发生的电极反应式为
②用上述电池做电源,用图3装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:
考点:物质的量或浓度随时间的变化曲线,反应热和焓变,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1 ,反应时气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,个成分含量保持不变,分析选项;
②依据图象分析计算二氧化碳的反应速率,结合反应速率之比等于化学方程式计量数之比计算氢气的反应速率;
③结合平衡移动方向,分析判断能使
增大选项;
④依据平衡浓度计算费用平衡常数,结合平衡常数增大需要平衡正向进行,平衡常数随温度变化分析判断;
(3)①依据原电池装置图象分析,氢离子移向正极,所以M为原电池负极,N为正极,负极是甲醇燃料失电子在酸性介质中生成二氧化碳,据此书写电极反应;
②电解饱和食盐水生成氯气、氢气和氢氧化钠,结合化学方程式书写离子方程式;依据电子守恒计算消耗甲醇质量.
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1 ,反应时气体体积减小的放热反应,反应达到平衡的标志是正逆反应速率相同,个成分含量保持不变,分析选项;
②依据图象分析计算二氧化碳的反应速率,结合反应速率之比等于化学方程式计量数之比计算氢气的反应速率;
③结合平衡移动方向,分析判断能使
| n(CH3OH) |
| n(CO2) |
④依据平衡浓度计算费用平衡常数,结合平衡常数增大需要平衡正向进行,平衡常数随温度变化分析判断;
(3)①依据原电池装置图象分析,氢离子移向正极,所以M为原电池负极,N为正极,负极是甲醇燃料失电子在酸性介质中生成二氧化碳,据此书写电极反应;
②电解饱和食盐水生成氯气、氢气和氢氧化钠,结合化学方程式书写离子方程式;依据电子守恒计算消耗甲醇质量.
解答:
解:(1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1;
②CH3OH(g)═CH3OH(l)△H=-b kJ?mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-c kJ?mol-1;
④H2O(g)═H2O(l)△H=-d kJ?mol-1,
依据盖斯定律计算③×
+2④-①-②得到表示CH3OH(l)燃烧热的热化学方程式为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ?mol-1;
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-(
c+2d-a-b)kJ?mol-1;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),反应是气体体积减小的放热反应;
A.CO2的体积分数在混合气体中保持不变,是破坏标志,故A符合;
B.平衡气体质量不变,反应前后气体物质的量减小,混合气体的平均相对分子质量不随时间的变化而变化,说明反应达到平衡,故B符合;
C.单位时问内每消耗1.2mol H2,同时生成0.4mol H2O,只能表示反应正向进行,不能说明反应达到平衡,故不符合;
D.化学方程式定量关系可知,反应过程中和平衡状态下,反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明反应达到平衡,故D不符合;
故答案为:AB;
②图象分析可知二氧化碳的反应速率V(CO2)=
=0.025mol/L?min;
反应速率之比等于化学方程式计量数之比,V(H2)=3V(CO2)=3×0.025mol/L?min=0.075 mol?L-1?min-1;
故答案为:0.075 mol?L-1?min-1;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),反应是气体体积减小的放热反应;下列措施中能使
增大的是
A.反应是放热反应,升高温度平衡逆向进行,使
减小,故A不符合;
B.恒温恒容下充入He(g),总压增大,分压不变,平衡不动,使
不变,故B不符合;
C.将H2O(g)从体系中分离,平衡正向进行,使
增大,故C符合;
D.恒温恒容再充入2mol CO2和3mol H2 ,增大压强平衡正向进行,使
增大,故D符合;
故答案为:CD;
④依据化学平衡三段式列式计算平衡浓度计算平衡常数
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 1.5 0 0
变化量(mol/L) 0.25 0.75 0.25 0.25
平衡量(mol/L) 0.75 0.75 0.25 0.25
平衡常数K=
≈0.20;
改变条件使平衡常数K=1,平衡需要正向进行,平衡常数随温度变化,不随浓度,压强催化剂改变;
A.增大压强,平衡正向进行,平衡常数不变,故A不符合;
B.增大反应物浓度,平衡正向进行,平衡常数不变,故B不符合;
C.降低温度平衡正向进行,平衡常数增大,故C符合;
D.升高温度,平衡逆向进行,平衡常数减小,故D不符合;
E.加入催化剂改变反应速率,不改变化学平衡,平衡常数不变,故E不符合;
故答案为:0.20;C;
(3)①依据原电池装置图象分析,氢离子移向正极,所以M为原电池负极,N为正极,负极是甲醇燃料失电子在酸性介质中生成二氧化碳,电极反应为CH3OH-6e-+H2O=CO2+6H+;
故答案为:CH3OH-6e-+H2O=CO2+6H+;
②电解饱和食盐水生成氯气、氢气和氢氧化钠,结合化学方程式书写离子方程式为:2Cl-+2H2O
H2↑+Cl2↑+2 OH-;
溶液体积为300mL,当溶液的pH值为13时,溶液中氢氧根离子浓度c(OH-)=0.1mol/L,生成氢氧根离子物质的量=消耗氢离子物质的量=0.1mol/L×0.3L=0.03mol,依据电极反应和电子守恒计算,CH3OH-6e-+H2O=CO2+6H+,2H++2e-=H2↑,CH3OH~6H+,甲醇物质的量=0.005mol,质量=0.005mol×32g/mol=0.16g;
故答案为:2Cl-+2H2O
H2↑+Cl2↑+2 OH-;0.16g.
②CH3OH(g)═CH3OH(l)△H=-b kJ?mol-1;
③2H2(g)+O2(g)═2H2O(g)△H=-c kJ?mol-1;
④H2O(g)═H2O(l)△H=-d kJ?mol-1,
依据盖斯定律计算③×
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
| 3 |
| 2 |
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),反应是气体体积减小的放热反应;
A.CO2的体积分数在混合气体中保持不变,是破坏标志,故A符合;
B.平衡气体质量不变,反应前后气体物质的量减小,混合气体的平均相对分子质量不随时间的变化而变化,说明反应达到平衡,故B符合;
C.单位时问内每消耗1.2mol H2,同时生成0.4mol H2O,只能表示反应正向进行,不能说明反应达到平衡,故不符合;
D.化学方程式定量关系可知,反应过程中和平衡状态下,反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明反应达到平衡,故D不符合;
故答案为:AB;
②图象分析可知二氧化碳的反应速率V(CO2)=
| 1.00mol/L-0.75mol/L |
| 10min |
反应速率之比等于化学方程式计量数之比,V(H2)=3V(CO2)=3×0.025mol/L?min=0.075 mol?L-1?min-1;
故答案为:0.075 mol?L-1?min-1;
③CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ?mol-1(a>0),反应是气体体积减小的放热反应;下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.反应是放热反应,升高温度平衡逆向进行,使
| n(CH3OH) |
| n(CO2) |
B.恒温恒容下充入He(g),总压增大,分压不变,平衡不动,使
| n(CH3OH) |
| n(CO2) |
C.将H2O(g)从体系中分离,平衡正向进行,使
| n(CH3OH) |
| n(CO2) |
D.恒温恒容再充入2mol CO2和3mol H2 ,增大压强平衡正向进行,使
| n(CH3OH) |
| n(CO2) |
故答案为:CD;
④依据化学平衡三段式列式计算平衡浓度计算平衡常数
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 1.5 0 0
变化量(mol/L) 0.25 0.75 0.25 0.25
平衡量(mol/L) 0.75 0.75 0.25 0.25
平衡常数K=
| 0.25×0.25 |
| 0.75×0.753 |
改变条件使平衡常数K=1,平衡需要正向进行,平衡常数随温度变化,不随浓度,压强催化剂改变;
A.增大压强,平衡正向进行,平衡常数不变,故A不符合;
B.增大反应物浓度,平衡正向进行,平衡常数不变,故B不符合;
C.降低温度平衡正向进行,平衡常数增大,故C符合;
D.升高温度,平衡逆向进行,平衡常数减小,故D不符合;
E.加入催化剂改变反应速率,不改变化学平衡,平衡常数不变,故E不符合;
故答案为:0.20;C;
(3)①依据原电池装置图象分析,氢离子移向正极,所以M为原电池负极,N为正极,负极是甲醇燃料失电子在酸性介质中生成二氧化碳,电极反应为CH3OH-6e-+H2O=CO2+6H+;
故答案为:CH3OH-6e-+H2O=CO2+6H+;
②电解饱和食盐水生成氯气、氢气和氢氧化钠,结合化学方程式书写离子方程式为:2Cl-+2H2O
| ||
溶液体积为300mL,当溶液的pH值为13时,溶液中氢氧根离子浓度c(OH-)=0.1mol/L,生成氢氧根离子物质的量=消耗氢离子物质的量=0.1mol/L×0.3L=0.03mol,依据电极反应和电子守恒计算,CH3OH-6e-+H2O=CO2+6H+,2H++2e-=H2↑,CH3OH~6H+,甲醇物质的量=0.005mol,质量=0.005mol×32g/mol=0.16g;
故答案为:2Cl-+2H2O
| ||
点评:本题考查了热化学方程式和盖斯定律计算分析化学平衡影响因素,平衡移动原理的分析判断,注意图象分析应用,原电池、电解池原理的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
元素性质呈周期性变化的决定因素是( )
| A、元素原子半径大小呈周期性变化 |
| B、元素原子的原子序数依次增加 |
| C、元素的最高正化合价呈周期性变化 |
| D、元素原子最外层电子排布呈周期性变化 |
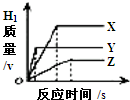 将相同体积、相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如图所示.下列说法中正确的是( )
将相同体积、相同溶质质量分教的稀盐酸,分别加入到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中(金属完全反应〕,生成H2的质量与反应时间的关系如图所示.下列说法中正确的是( )| A、三种金属的活动性顺序为Y>X>Z |
| B、产生氢气的速率顺序为X>Y>Z |
| C、消耗稀盐酸的质量顺序为Z>Y>X |
| D、相对原子质量由大到小的顺序为X>Y>Z |
下列化学用语表示正确的是( )
| A、高氯酸的化学式:HClO3 |
B、氮气的电子式: |
C、氟原子结构示意图: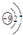 |
| D、乙烯的结构简式:CH2CH2 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温下,18g H2O中含H2数目为NA |
| B、标准状况下,22.4L H2O中含有化学键的数目为2NA |
| C、将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D、常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |