题目内容
11.现有几组物质的熔点数据如下表:| A组 | B组 | C组 | D组 |
| 金刚石:3110℃ | Li:181℃ | HF:-83℃ | NaCl:801℃ |
| 硅晶体:1410℃ | Na:98℃ | HCl:-114℃ | KCl:776℃ |
| 硼晶体:2300℃ | K:64℃ | HBr:-89℃ | RbCl:718℃ |
| 二氧化硅:1723℃ | Rb:39℃ | HI:-51℃ | CsCl:645℃ |
(1)A组属于原子晶体晶体,其熔化时克服的微粒间的作用力是共价键;
(2)B组晶体共同的物理性质是①②③④(填序号);①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于HF分子间存在氢键;
(4)D组晶体可能具有的性质是②④(填序号);①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电.
分析 (1)根据物质的组成和熔点可知A组属于原子晶体,B组属于金属晶体,C组形成分子晶体,D组是离子晶体;
(2)B组物质为金属晶体,具有金属的通性;
(3)HF分子间存在氢键,据此解答即可;
(4)D组物质为离子晶体,根据离子晶体的性质判断.
解答 解:(1)A组熔点最高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键,故答案为:原子;共价键;
(2)B组物质为金属,具有金属光泽、导电性、导热性、延展性,故答案为:①②③④;
(3)HF分子之间存在氢键,熔沸点高于同主族其它非金属性氢化物,熔沸点出现反常,故答案为:HF分子之间存在氢键;
(4)D组物质为离子晶体,有硬度大、水溶液能导电、固体不能导电而熔融状态能导电的性质,故答案为:②④.
点评 本题主要考查的是晶体类型的判断以及其性质、氢键以及金属的通性等,注意对晶体类型的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.将下列各组物质按单质、氧化物、酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 液态氧、干冰、硫酸、烧碱、氯化钠 | B. | 碘酒、冰、盐酸、烧碱、食盐 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱、硝酸钾 | D. | 铜、硫酸钠、醋酸、石灰水、氯化铜 |
15.在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中发生下述反应:PCl3(g)+Cl2(g)?PCl5(g);5min末达到平衡,有关数据如表.
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
12.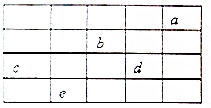 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
 如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )
如图所示,a、b、c、d、e为周期表前4周期的一部分元素,下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的天然氧化物可被称为刚玉 | |
| C. | b、d气态氢化物溶于水,溶液的酸性:b>d | |
| D. | c、d气态氢化物的稳定性:d>c |
6.取两个相同容积的密闭恒容容器,在A容器中充入0.2molN2O4,B容器中充入0.2molHI气体,在一定温度下反应分别达到平衡,测得N2O4和HI的分解率分别为a(A)和a(B).在该平衡体系中再分别充入0.2molN2O4和0.2molHI,当反应重新达到平衡时,测得N2O4和HI的分解率分别为a′(A)和a′(B).下列判断一定正确的是( )
| A. | a(A)>a′(A) a(B)<a′(B) | B. | a(A)>a′(A) a(B)=a′(B) | C. | a(A)<a′(A) a(B)<a′(B) | D. | a(A)=a′(A) a(B)>a′(B) |
16.下列关于电解质溶液的正确判断是( )
| A. | 加水稀释,氨水溶液中导电粒子的数目减少 | |
| B. | 通入HCl气体,氨水溶液中NH3•H2O的电离平衡向右移动,溶液的pH增大 | |
| C. | 由0.1mol/L一元碱BOH溶液的 pH=10,可推知BOH溶液中存在BOH═B++OH- | |
| D. | 由0.1mol/L一元酸HA溶液的 pH=3,可推知NaA溶液中存在A-+H2O═HA+OH- |
3.在一定条件下,反应A2(g)+B2(g)═2AB(g) 达到平衡状态的是( )
| A. | 单位时间内生成n mol的AB的同时,生成n mol的A2 | |
| B. | 单位时间内生成n mol A2的同时,生成n mol的B2 | |
| C. | 容器内的总压强不随时间而变化 | |
| D. | 单位时间内生成2n mol AB的同时,生成n mol的B2 |
20.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在标准状况下,11.2LCI2含有的分子数为NA | |
| B. | 32gO2中所含有的氧原子数为NA | |
| C. | 2.4g镁变成镁离子,转移的电子数为0.2NA | |
| D. | 1L0.3mol/LK2SO4溶液中含有的K+数为0.3NA |
1.为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是( )
| A. | Fe3+易水解,它的水解产物之一能抑制的Fe2+水解 | |
| B. | Fe2+有较强的还原性,它能还原Fe3+ | |
| C. | Fe3+有较强的氧化性,它能氧化Fe2+ | |
| D. | Fe3+的水解是吸热反应,升温能促进它的水解 |