题目内容
1.已知反应:2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O 该反应中H2O2只发生如下变化过程:H2O2→O2(1)该反应中的还原剂是H2O2,氧化剂是H2CrO4
(2)在反应方程式中标明电子转移的方向和数目

(3)如反应中转移了0.3mol电子,则产生的气体在标准状况下体积为3.36L.
分析 2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O中,H2O2只发生H2O2→O2,O元素的化合价由-1价升高为0,则Cr元素的化合价由+6价降低为+3价,以此来解答.
解答 解:(1)由H2O2→O2可知,氧元素的化合价由-1→0,化合价升高,故该反应中的还原剂为H2O2,Cr元素的化合价降低,则为氧化剂H2CrO4,
故答案为:H2O2;H2CrO4;
(2)Cr化合价从+6→+3,得电子,O化合价从-1→0,失电子,因此箭头指向由O指向Cr,电子总数为2×(6-3)=6,用单线桥法表示反应中电子转移的方向和数目如下: ,故答案为:
,故答案为: ;
;
(3)由反应可知,转移6mol电子生成3mol气体,则反应中转移了0.3mol电子,则产生的气体在标准状况下体积为0.15mol×22.4L/mol=3.36L,故答案为:3.36L.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.下列物质中,不能把醛类物质氧化的是( )
| A. | 银氨溶液 | B. | 金属钠 | C. | 氧气 | D. | 新制氢氧化铜 |
13.下列化工生产过程的反应原理,不涉及氧化还原反应的是( )
| A. | 氯碱工业 | B. | 从海水中提取镁 | C. | 高炉炼铁 | D. | 侯德榜制碱 |
 .
. 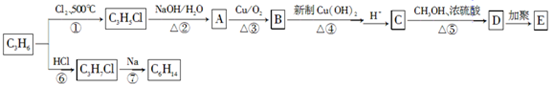
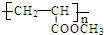 .
. +6NaBr.
+6NaBr.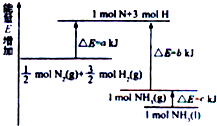 氮及其化合物与科技、生活等密切相关.
氮及其化合物与科技、生活等密切相关.