题目内容
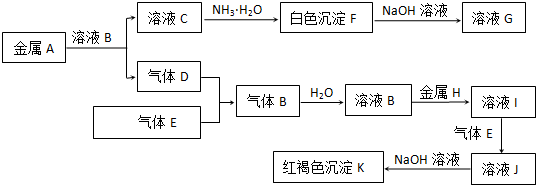
10.请结合下图回答问题: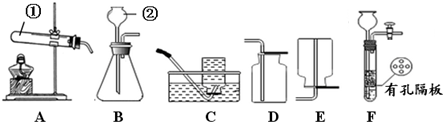
(1)写出有标号的仪器名称:①试管,②长颈漏斗.
(2)实验室用高锰酸钾制取O2的化学方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,用A、C装置制取O2时,为防止高锰酸钾进入导管,可采取的措施是在试管口放一小团棉花.
(3)实验室用B、D装置制取CO2的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,若将发生装置由B改为F,其优点是可随时控制反应的发生和停止.
(4)SO2是无色有刺激性气味的有毒气体,密度比空气大,易溶于水.SO2的某些化学性质与CO2相似,实验中常用NaOH溶液吸收SO2尾气.用下图所示装置收集一瓶干燥的SO2,装置中导管按气流方向连接顺序是①→②→④→③→⑤(填序号);图中漏斗的作用是防止倒吸现象;烧杯中NaOH溶液的作用是2NaOH+SO2=Na2SO3+H2O(用化学方程式表示).

分析 (1)由图中装置及常见仪器可知仪器的名称;
(2)高锰酸钾制取O2,加热高锰酸钾分解生成氧气、锰酸钾、二氧化锰;用A、C装置制取O2时,为防止高锰酸钾进入导管,可在试管口利用棉花团处理;
(3)用B、D装置制取CO2,为固体、液体反应不加热装置,利用碳酸钙与盐酸反应即可;将发生装置由B改为F,F中有分液漏斗,可利用活塞控制液体的量;
(4)图示装置收集一瓶干燥的SO2,先干燥气体、再收集,最后尾气处理,倒扣的漏斗可防止液体倒吸,烧杯中NaOH吸收二氧化硫,防止二氧化硫污染环境,以此来解答.
解答 解:(1)由图可知,仪器①为试管,②为长颈漏斗,故答案为:试管;长颈漏斗;
(2)高锰酸钾制取O2,加热高锰酸钾分解生成氧气、锰酸钾、二氧化锰,反应方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;用A、C装置制取O2时,为防止高锰酸钾进入导管,可在试管口放一小团棉花,保证粉末不能堵塞导管,故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;在试管口放一小团棉花;
(3)用B、D装置制取CO2,为固体、液体反应不加热装置,利用碳酸钙与盐酸反应即可,反应方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;将发生装置由B改为F,F中有分液漏斗,其优点是可随时控制反应的发生和停止,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;可随时控制反应的发生和停止;
(4)图示装置收集一瓶干燥的SO2,先干燥气体、再收集,最后尾气处理,则装置中导管按气流方向连接顺序是①→②→④→③→⑤;图中漏斗的作用是可防止倒吸现象,烧杯中NaOH吸收二氧化硫,防止二氧化硫污染环境,反应为2NaOH+SO2=Na2SO3+H2O,
故答案为:①→②→④→③;防止倒吸现象;2NaOH+SO2=Na2SO3+H2O.
点评 本题考查常见气体的制备实验及性质实验,为高频考点,把握气体的制备原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 使用青霉素时,不用进行试验直接静脉注射 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 对于标记“OTC”的药物,必需在医生指导下使用 |
| A. | 电解质溶液在通电时才可以电离 | B. | 金属氧化物一定都是碱性氧化物 | ||
| C. | 非金属氧化物都是酸性氧化物 | D. | 碱性氧化物一定都是金属氧化物 |
| A. | “暖冰”中水分子上的3个原子位于同一条直线上 | |
| B. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| C. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |