题目内容
16.已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则(1)X是H、Y是N、Z是O
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物的化学式(分子式)是N2O5
(3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是NH4+和OH-.
分析 X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,则X为H元素;
Z原子的最外层电子数是次外层电子数的三倍,最外层电子数不超过8个,则Z的次外层是K层,Z最外层电子数6,为O元素;
Y和Z可以形成两种以上气态化合物,则Y是N元素,再结合题目分析解答.
解答 解:X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,则X为H元素;
Z原子的最外层电子数是次外层电子数的三倍,最外层电子数不超过8个,则Z的次外层是K层,Z最外层电子数6,为O元素;
Y和Z可以形成两种以上气态化合物,则Y是N元素,
(1)通过以上分析知,X、Y、Z分别是H、N、O元素,故答案为:H;N;O;
(2)由Y和Z组成,且Y和Z质量比为7:20的化合物中,Y、Z的原子个数之比=$\frac{7}{14}$:$\frac{20}{16}$=2:5,则该化合物的化学式为N2O5,故答案为:N2O5;
(3)水分子中含有10个电子,由X、Y、Z中的两种元素组成,且与H2O分子具有相同电子数的两种离子是NH4+、OH-,故答案为:NH4+;OH-.
点评 本题考查位置结构性质的相互关系及应用,正确判断元素是解本题关键,熟记常见10电子、18电子微粒,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
6.如表是元素周期的一部分,出了七种元素的周期表中的位置:
请用化学符号按要求回答下列问题:
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是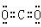
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)这七种元素中,非金属性最强的是F,在元素周期表中的位置第二周期ⅦA族
(2)元素①与②形成摩尔质量为44g/mol的物质,它的电子式是
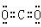
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是Al>Cl>F.
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2>Al(OH)3.
4.下列有关叙述正确的是( )
| A. | 1 L0.6mol•L-1的食盐水中含氯化钠0.6mol | |
| B. | 0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5mol•L-1 | |
| C. | 标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2mol•L-1 | |
| D. | 20g氢氧化钠溶于水配成物质的量浓度为1mol•L-1的溶液,可得溶液1L |
5.下列关于药物的使用说法正确的是( )
| A. | 虽然药物能治病,但大部份药物有毒副作用 | |
| B. | 使用青霉素时,不用进行试验直接静脉注射 | |
| C. | 长期大量使用阿司匹林可预防疾病,没有副作用 | |
| D. | 对于标记“OTC”的药物,必需在医生指导下使用 |
6.下列离子方程式书写正确的是( )
| A. | 钠与水的反应Na++H2O═OH-+H2↑ | |
| B. | NaOH溶液与CuSO4的反应OH-+H+═H2O | |
| C. | AlCl3溶液中加入过量氨水Al3++4OH-═AlO2-+2H2O | |
| D. | Fe(OH)3沉淀中滴加盐酸Fe(OH)3+3H+═Fe3++3H2O |

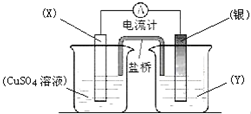 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.