题目内容
【题目】已知H2O2分子的结构如图所示: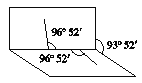 H2O2分子不是直线型的,两个H原子犹如在半展开的书的两面线上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,试回答:
H2O2分子不是直线型的,两个H原子犹如在半展开的书的两面线上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,试回答:
(1)写出H2O2分子的电子式________,其结构式为________。
(2)从极性键、非极性键角度写出分子内的化学键类型________。
(3)估计它难溶于CS2,简要说明原因______________________________________。
(4)指出氧元素的化合价,简要说明原因________________________________。
【答案】 ![]()
 既有极性键又有非极性键 因H2O2为极性分子,CS2为非极性分子,椐相似相溶原理,H2O2难溶于CS2 O为-1价,因O—O键为非极性键,共用电子对不偏移;而O—H键为极性键,共用电子对偏向于氧原子,故O为-1价
既有极性键又有非极性键 因H2O2为极性分子,CS2为非极性分子,椐相似相溶原理,H2O2难溶于CS2 O为-1价,因O—O键为非极性键,共用电子对不偏移;而O—H键为极性键,共用电子对偏向于氧原子,故O为-1价
【解析】本题主要考查分子结构。
(1)在H2O2分子中H原子达到2电子稳定结构,O原子最外层电子达到8电子稳定结构,H2O2分子的电子式为![]() ,其结构式为
,其结构式为![]() 。
。
(2)在H2O2分子中H—O共价键属于极性键,O—O共价键属于非极性键,所以H2O2分子内既有极性键又有非极性键。
(3))估计它难溶于CS2,简要说明原因:因H2O2为极性分子,CS2为非极性分子,椐相似相溶原理,H2O2难溶于CS2。
(4)指出氧元素的化合价,简要说明原因:O为-1价,因O—O键为非极性键,共用电子对不偏移;而O—H键为极性键,共用电子对偏向于氧原子,故O为-1价。

【题目】研究氮的氧化物、碳的氧化物等大气污染物的处理具有重要意义。
I. 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1 ②CO的燃烧热△H= - 283 kJ·mol-1
(1)汽车排气管内安装的催化转化器,可使尾气中主要污染物(NO和CO)转化为无毒的大气循环物质,该反应的热化学方程式为_________________________________________________。
(2)一定温度下,在恒容密闭容器中充入1 molNO和2 molCO进行该反应,下列能判断反应达到化学平衡状态的是_______。
①单位时间内消耗a mo1 CO的同时生成2a mol NO
②混合气体的平均相对分子质量不再改变
③混合气体中NO和CO的物质的量之比保持不变
④混合气体的密度不再改变
II. 臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
N2O5(g)+O2(g),向甲、乙两个体积都为1.0 L的恒容密闭容器中分别充入2.0 mol NO2和1.0 mol O3,分别在T1、T2温度下,经过一段时间后达到平衡。反应过程中n(O2)随时间(t)变化情况见下表:
t/s | 0 | 3 | 6 | 12 | 24 | 36 |
甲容器(T1)n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 | 0.80 |
乙容器(T2)n(O2)/mol | 0 | 0.30 | 0.50 | 0.70 | 0.85 | 0.85 |
(3)T1___T2(填>、<或=,下同),该反应ΔH___0 。简述理由________________________________。
(4)甲容器中,0~3s内的平均反应速率v(NO2)=______________________。
(5)甲容器中NO2平衡转化率为________,T1时该反应的平衡常数为_______________________。
III. 将NO2(g)转化为N2O4(g)

(6)石墨I为______极(选填正、负),Y化学式为_________。
(7)II电极反应式为_________________________________________。
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | |||||||
(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。
试写出:
(1)a粒子的原子结构示意图是________;b粒子的电子排布式为________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,d分子的空间构型为________,键角为________;若d为正四面体形分子,其电子式为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。


