题目内容
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | |||||||
(单位电荷) | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。
试写出:
(1)a粒子的原子结构示意图是________;b粒子的电子排布式为________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
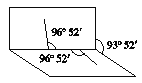
(3)若d极易溶于水,在水溶液中变化的方程式为________,d分子的空间构型为________,键角为________;若d为正四面体形分子,其电子式为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
【答案】 ![]() 1s22s22p6 NaOH>Mg(OH)2 NH3+H2O
1s22s22p6 NaOH>Mg(OH)2 NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH- 三角锥形 107°
+OH- 三角锥形 107° 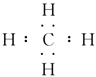 OH- H3O+ OH-+H3O+===2H2O
OH- H3O+ OH-+H3O+===2H2O
【解析】本题主要考查原子结构和分子结构。根据题意判断a为Ne,b为Na+,c为OH-,d为NH3或CH4,e为Mg2+,f为H3O+,g为H2O。
(1)a粒子的原子结构示意图是![]() ;b粒子的电子排布式为1s22s22p6。
;b粒子的电子排布式为1s22s22p6。
(2)金属性:Na>Mg ,所以b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为NaOH>Mg(OH)2。
(3)若d极易溶于水,则d为氨,其在水溶液中变化的方程式为NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH
NH![]() +OH-,d分子的空间构型为三角锥形,键角为107°;若d为正四面体形分子,则d为甲烷,其电子式为
+OH-,d分子的空间构型为三角锥形,键角为107°;若d为正四面体形分子,则d为甲烷,其电子式为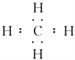 。
。
(4)c粒子是OH-,f粒子是H3O+,由c、f生成g的离子方程式是OH-+H3O+===2H2O。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案