题目内容
【题目】常温下,CH3COOH和NH3.H2O的电离常数均为1.8×10-5mol/L。向20mL浓度均为0.1mol/LNaOH和NH3.H2O的混合液中滴加等浓度的CH3COOH溶液,所得混合液的相对导电能力与加入CH3COOH溶液的体积(V)关系如图所示。下列说法正确的是( )

A.由A点溶液到B点溶液相对导电能力降低主要是因为离子的总物质的量减少
B.A、B、C、D四点溶液中B点溶液中水的电离程度最大
C.C点溶液呈碱性
D.D点溶液中存在: c(Na+)>c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
【答案】C
【解析】
溶液的导电能力与离子浓度成正比,向混合溶液中加入等物质的量浓度的CH3COOH溶液时,发生反应先后顺序是NaOH+CH3COOH=CH3COONa+H2O、NH3·H2O+CH3COOH=CH3COONH4+H2O,0-20溶液的导电能力减小,B点最小,因为溶液体积增大导致B点离子浓度减小,B点溶液中溶质为CH3COONa、NH3·H2O,继续加入醋酸溶液,NH3·H2O是弱电解质,生成的CH3COONH4是强电解质,导致溶液中离子浓度增大,溶液的导电能力增大,C点时醋酸和一水合氨恰好完全反应生成醋酸铵,C点溶液中溶质为CH3COONa、CH3COONH4,且二者的物质的量相等,D点溶液中溶质为等物质的量浓度的CH3COONa、CH3COONH4、CH3COOH。
A.由A点溶液到B点溶液相对导电能力降低主要是因为溶液体积增大导致B点离子浓度减小,故A错误;
B.C点溶液中溶质为CH3COONa、CH3COONH4,两物质均能水解,促进水电离,B点溶液中溶质为CH3COONa、NH3·H2O,一水合氨抑制水电离,故B错误;
C.C点溶液中溶质为CH3COONa、CH3COONH4,醋酸铵溶液呈中性,CH3COONa水解呈碱性,故C正确;
D.D点溶液中溶质为等物质的量浓度的CH3COONa、CH3COONH4、CH3COOH,醋酸根离子部分水解但水解程度较小,以醋酸电离为主,所以存在c(CH3COO-)>c(Na+)>c(NH4+)>c(H+)>c(OH-),故D错误;
故选C。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
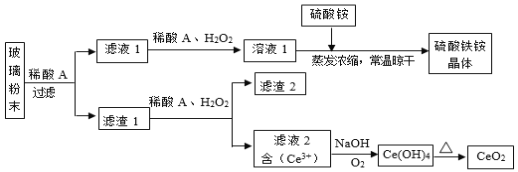
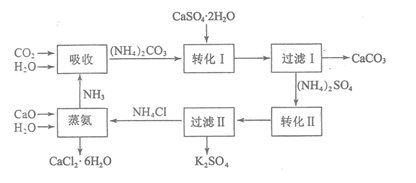
【题目】磷石膏是磷氨厂生产硫酸和磷酸所排放的废渣![]() 主要成分为
主要成分为![]() ,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
,大量堆积既占用土地,又易造成环境污染和硫资源的浪费,所以可从资源综合利用的角度将磷石膏转化成硫酸钾和氯化钙晶体,工艺流程如下:
请回答以下问题:
![]() 为了提高原料的利用率,吸收流程中通入
为了提高原料的利用率,吸收流程中通入![]() 和
和![]() 的先后顺序最好为______。
的先后顺序最好为______。
![]() 碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
碳酸铵溶液与磷石膏悬浊溶液混合后发生转化I的离子反应方程式为______。
![]() 工艺流程中除了所给出的
工艺流程中除了所给出的![]() 、
、![]() 、
、![]() 、
、![]() 等原料外,在转化Ⅱ的过程中还需要加入______原料。
等原料外,在转化Ⅱ的过程中还需要加入______原料。
![]() 过滤Ⅱ后所得滤液
过滤Ⅱ后所得滤液![]() 溶液,确认其中含有
溶液,确认其中含有![]() 的方法是:______;
的方法是:______;
![]() 氯化钙结晶水合物
氯化钙结晶水合物![]() 是目前常用的无机储热材料,选择的依据是因为______
是目前常用的无机储热材料,选择的依据是因为______![]() 选填序号
选填序号![]() ;
;
A.熔点较低![]() 熔化
熔化![]()
![]() 能导电
能导电![]() 能制冷
能制冷![]() 无毒
无毒
![]() 已知不同温度下
已知不同温度下![]() 在100g水中达到饱和时溶解的量如下表:
在100g水中达到饱和时溶解的量如下表:
温度 | 0 | 20 | 60 |
|
|
|
|
![]() 时
时![]() 的饱和溶液
的饱和溶液![]() 冷却到
冷却到![]() ,可析出
,可析出![]() 晶体______g。
晶体______g。
![]() 上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______
上述工艺流程中循环利用的物质是______;还有一种物质,只要其纯净,也可以被循环利用,它是______![]() 均填化学式
均填化学式![]() 。
。
【题目】甲胺![]() 是合成太阳能敏化剂的原料。一定温度下,在三个体积均为
是合成太阳能敏化剂的原料。一定温度下,在三个体积均为![]() 的恒容密闭容器中按不同方式投入反应物,发生反应
的恒容密闭容器中按不同方式投入反应物,发生反应![]() ,测得有关实验数据如表,下列说法正确的是
,测得有关实验数据如表,下列说法正确的是
容器编号 | 温度 | 起始物质的量 | 平衡时物质的量 | ||||
|
|
|
| CH3NH2(g) |
| ||
Ⅰ | 530 |
|
| 0 | 0 |
| |
Ⅱ | 530 |
|
| 0 | 0 | ||
Ⅲ | 500 | 0 | 0 |
|
|
| |
A.达到平衡时,体系中![]() 关系:
关系:![]() ,Ⅰ
,Ⅰ![]() ,Ⅱ
,Ⅱ![]()
B.达到平衡时,转化率:![]() ,Ⅲ
,Ⅲ![]()
C.正反应的平衡常数![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() Ⅲ
Ⅲ![]()
D.530K时,若起始向容器Ⅰ中充入![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() ,则反应将向逆反应方向进行
,则反应将向逆反应方向进行