题目内容
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
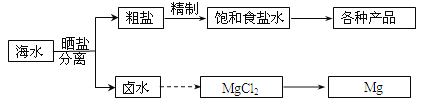
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
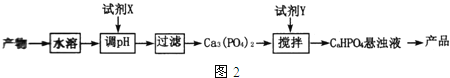
①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
【答案】AlP+3H2O=Al(OH)3+PH3 PH或电导率 共价 二 3:10 2Ca(ClO)2+PH3=H3PO4+2CaCl2 ClO-+H2OHClO+OH- Ca(OH)2或CaO > 水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性
【解析】
⑴根据题意写出反应方程式。
⑵根据已知信息,检验空气中微量的磷化氢主要是看溶液的pH值或电导率,HgCl2溶于水,所得溶液几乎不导电,说明不存在离子,因此在溶液中不电离则为共价化合物。
⑶根据甲足量氢氧化钠溶液得到NaH2PO2得出亚磷酸为二元酸;根据化合价升降守恒和生成的产物中质量守恒分析得出白磷和氢氧化钠的物质的量之比。
⑷根据氧化还原反应原理书写化学方程式,次氯酸要水解生成的次氯酸更快的与磷化氢反应。
⑸磷酸被氢氧化钙或氧化钙反应生成磷酸钙,CaHPO4溶液中水解程度大于电离程度,因此溶液显碱性。
⑴磷化铝(AlP)片剂,遇水蒸气放出PH3气体,化学方程式为AlP+3H2O=Al(OH)3+PH3,故答案为:AlP+3H2O=Al(OH)3+PH3。
⑵HgCl2溶于水,所得溶液几乎不导电,发生反应PH3+3HgCl2=P(HgCl)3↓+3HCl,氯化氢易溶于水,所以可以通过测定溶液pH或电导率变化,准确测定空气中微量的PH3。HgCl2溶于水,所得溶液几乎不导电,说明不能电离出离子,因此HgCl2属于共价化合物,故答案为:pH或电导率;共价。
⑶①根据在足量的NaOH溶液作用下生成的亚磷酸钠的化学式得出亚磷酸属于二元酸,故答案为:二。
②当反应I生成的n(NaH2PO2):n(Na2HPO3) = 3:1时,假设n(NaH2PO2) = 3 mol,n(Na2HPO3) = 1 mol,则化合价升高+1×3 + (+3)×1 = 6,白磷中磷的化合价降低变为PH3,一个磷降低3个价态,需要2mol磷降低,因此总消耗磷的物质的量为3+1 + 2 = 6mol,即白磷1.5 mol,消耗氢氧化钠物质的量为3mol×1 + 1mol×2 = 5mol,因此参加反应的n(P4):n(NaOH) = 1.5:5 =3:10,故答案为3:10。
⑷用漂白粉可将PH3氧化为H3PO4,化学方程式为2Ca(ClO)2+PH3=H3PO4+2CaCl2,含有水蒸气时可加快PH3的氧化过程,次氯酸钙水解生成次氯酸,次氯酸具有更强的氧化性,可以更快地氧化磷化氢,因此离子方程式表示原因为ClO- + H2O HClO + OH-,故答案为:2Ca(ClO)2+PH3= H3PO4+ 2CaCl2;ClO- + H2O HClO + OH-。
⑸①试剂X主要是将磷酸等物质转变为磷酸钙,因此X试剂主要是Ca(OH)2或CaO,故答案为:Ca(OH)2或CaO。
②CaHPO4悬浊液中有HPO32-,HPO32-既能电离,也能水解,电离常数为H3PO4的第三步电离常数,即Ka3=4.4×10-13,水解常数Kh=![]() =
=![]() =1.59×10-7>Ka3,所以主要是水解为主,因此CaHPO4悬浊液pH >7,故答案为:>;水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性。
=1.59×10-7>Ka3,所以主要是水解为主,因此CaHPO4悬浊液pH >7,故答案为:>;水解常数Kh=1.59×10-7>Ka3=4.4×10-13,水解程度大于电离程度,溶液呈碱性。

 星级口算天天练系列答案
星级口算天天练系列答案