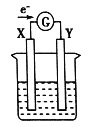
��Ŀ����
����Ŀ��ijͬѧ��Ƽ���ͼ��ʾװ�D�����ּг�װ�ü���ȥ������ʵ��̽���� 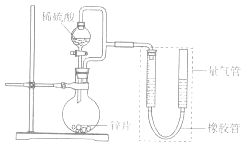
��1��������װ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ�������9.0mL����Ϊ��ʱ�յ㣬���Ϊt1��t2 ��
��� | V��H2SO4��/mL | C��H2SO4��/molL��1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
�ٱȽ�ʵ��I�͢���Եó���ʵ������� ��
������пƬ���ɺ����ʵĴ�пƬ����������ʹ��������һ�£�����õķ�Ӧ���ʾ���������ʵ���Ӧ�����ݣ���пƬ���������ʿ�����������ţ���
A���������� B���� C��ͭ D��ʯī
��2��������װ����֤�����ڳ�ʪ�����лᷢ��������ʴ ��Բ����ƿ�е��Լ���ѡ��������ţ�
A��ϡHCl B��NaCl��Һ C���Ҵ� D��NaOH��Һ
����֤�������ڳ�ʪ�����лᷢ��������ʴ�������� ��
���𰸡�
��1������������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ����������BCD
��2��BD���������Ҷ�Һ���½������Һ������
���������⣺��1����t1��t2 �� ˵��ʵ���Ӧ���ʽϴ���Ũ�Ȳ�ͬ��˵������������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ���������� ���Դ��ǣ�����������һ��ʱ����ѧ��Ӧ�����淴Ӧ��Ũ�ȵ�����������ɷ�Ӧ���ʴ�������ʵ���Ӧ�����ݿ�֪�������ʱ�����п�γ�ԭ��أ�ʹ��Ӧ��������п����������п�����õĽ�����ǽ����������������ʿ���������ͭ��ʯī��
���Դ��ǣ�BCD����2���ٸ��������Ի���Ի���������������ʴ���Ҵ��Ƿǵ���ʲ����磬
���Դ��ǣ�BD����������ʴ������������ƿ��ѹǿ��С�����������Ҷ�Һ���½������Һ��������
���Դ��ǣ��������Ҷ�Һ���½������Һ��������
�����㾫����������Ĺؼ�������������ĵ绯ѧ��ʴ����������֪ʶ�����ս����ı�����Ϳ�����㣻���ָ���ı�������ڲ��ṹ��ʹ���ȶ���������������������������һ�ָ�Ϊ���õĽ�����Ҫ�����Ľ�������ԭ��أ���ӵ�Դ����