题目内容
【题目】在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同.试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是( )
A.若M(甲)>M(乙),则分子数:甲>乙
B.若M(甲)<M(乙),则气体摩尔体积:甲>乙
C.若M(甲)<M(乙),则气体的压强:甲>乙
D.若M(甲)>M(乙),则气体体积:甲<乙
【答案】C
【解析】解:A.根据n= ![]() ,若M(甲)>M(乙),则n(甲)<n(乙),则气体的分子数:甲>乙,故A正确;
,若M(甲)>M(乙),则n(甲)<n(乙),则气体的分子数:甲>乙,故A正确;
B.根据n= ![]() ,若M(甲)<M(乙),则气体的物质的量:甲>乙,又根据ρ=
,若M(甲)<M(乙),则气体的物质的量:甲>乙,又根据ρ= ![]() 可知气体的体积相等,根据Vm=
可知气体的体积相等,根据Vm= ![]() ,故则气体的摩尔体积:甲<乙,故B错误;
,故则气体的摩尔体积:甲<乙,故B错误;
C.若M(甲)<M(乙),根据n= ![]() ,则气体的物质的量:甲>乙,由PV=nRT可知,气体的压强:甲>乙,故C正确;
,则气体的物质的量:甲>乙,由PV=nRT可知,气体的压强:甲>乙,故C正确;
D.两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ= ![]() 可知气体的体积相等,故D错误;
可知气体的体积相等,故D错误;
故选C.
相同温度下,在两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ= ![]() 可知气体的体积相等,结合n=
可知气体的体积相等,结合n= ![]() 以及PV=nRT比较压强大小,根据Vm=
以及PV=nRT比较压强大小,根据Vm= ![]() 比较气体摩尔体积大小,根据n=
比较气体摩尔体积大小,根据n= ![]() 判断气体的物质的量,气体物质的量越大,气体分子数越多.
判断气体的物质的量,气体物质的量越大,气体分子数越多.

 53随堂测系列答案
53随堂测系列答案【题目】某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究: 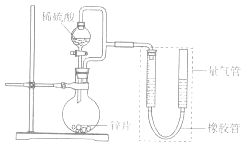
(1)用上述装置探究影响化学反应速率的因素.以生成9.0mL气体为计时终点,结果为t1>t2 .
序号 | V(H2SO4)/mL | C(H2SO4)/molL﹣1 | t/s |
I | 40 | 1 | t1 |
II | 40 | 4 | t2 |
①比较实验I和Ⅱ可以得出的实验结论是 .
②若将锌片换成含杂质的粗锌片,其他条件使其与上述一致,所测得的反应速率均大于上述实验对应的数据.粗锌片中所含杂质可能是(填序号).
A.二氧化硅 B.银 C.铜 D.石墨
(2)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀 ①圆底烧瓶中的试剂可选用(填序号)
A.稀HCl B.NaCl溶液 C.乙醇 D.NaOH溶液
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 .




