题目内容
20.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | Cl- 不可能存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | K+一定存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
分析 第一份溶液加入AgNO3溶液有沉淀产生,推得可能含有Cl-、CO32-、SO42-;
第二份溶液加足量NaOH溶液加热后收集到气体,推得一定含有NH4+,一定不存在Mg2+;
第三份溶液利用发生的离子反应,经过计算、推得一定存在CO32-、SO42-,一定不存在Ba2+,根据溶液中阴阳离子的电荷守恒,即可推出K+一定存在,由K+物质的量的变化分析Cl-的情况.
解答 解:第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-;
第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,而没有沉淀产生说明一定不存在Mg2+,故可确定一定含有NH4+,一定不存在Mg2+,NH4+也为0.04mol,
第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤.干燥后,沉淀质量为2.33g.部分沉淀溶于盐酸为BaCO3,部分沉淀不溶于盐酸为BaSO4,发生反应CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,
因为BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+.
由条件可知BaSO4为2.33g,物质的量为$\frac{2.33g}{233g/mol}$═0.01mol,
BaCO3为6.27g-2.33g═3.94g,物质的量为$\frac{3.94g}{197g/mol}$═0.02mol,
则CO32-物质的量为0.02mol,
由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,一定不存在Mg2+、Ba2+.而CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒,可知K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中存在Cl-,只有C正确.
故选C.
点评 本题考查离子的检验,为高频考点,侧重于学生的分析、计算能力的考查,题目采用定性实验和定量计算分析相结合的模式,增大了解题难度,同时涉及离子共存、离子反应等都是解题需注意的信息,尤其是K+的确定易出现失误.

| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体. |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
(1)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
实验③2Na+2H2O=2NaOH+H2↑
实验④Mg+2HCl=MgCl2+H2↑,
实验⑤2Al+6HCl=2AlCl3+3H2↑;
(2)实验结论:同周期从左至右元素金属性减弱,非金属性增强.
| A. | 工业上用热还原法冶炼铁:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | |
| B. | 硫酸工业、合成氨工业和氯碱工业均采用了循环操作提高原料的利用率 | |
| C. | 利用反应:NaCl(饱和)+CO2+NH3+H2O=NaHCO3↓+NH4Cl制取NaHCO3时,应先通入过量的NH3,再通入过量的CO2 | |
| D. | 硫酸生产中常采用高压条件提高SO2的转化率 |
| A. | 碳酸的电离方程式:H2CO3?H++CO32- | |
| B. | 少量二氧化硫通入氢氧化钠溶液中的化学方程式:SO2+NaOH═NaHSO3 | |
| C. | 碳酸氢钠溶液显碱性:HCO3-+H2O═H3O++CO32- | |
| D. | 向小苏打溶液中加入过量的石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| A. | Fe3+、F-、Cl- | B. | Mg2+、SO42-、Br- | C. | Mg2+、Cl-、Fe2+ | D. | Na+、NH4+、Cu2+ |
| A. | ②①③④ | B. | ①②③④ | C. | ④②①③ | D. | ①②④③ |
| A. | 常温常压下,32g氧气所含的原子数为NA | |
| B. | 标准状况下,22.4L 四氯化碳的分子数为NA | |
| C. | 0℃,101KPa下,44.8L氮气所含有的分子数为2NA | |
| D. | 常温常压下,1mol氦气含有的分子数为2NA |
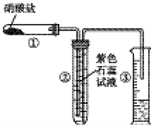 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究.他们设计了如图装置分别加热了NaNO3、Cu(NO3)2、AgNO3.(加热及夹持装置未画出) 电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.