题目内容
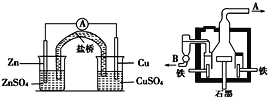
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
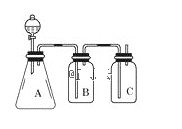
(1)若锥形瓶A中装某可溶性正盐溶液,其化学式为__。
(2)装置B所盛的试剂是__,其作用是__。
(3)装置C所盛试剂溶质的化学式是__。C中反应的离子方程式是__。
(4)由此可得出的结论是:酸性__>__>__。
【答案】Na2CO3(或K2CO3、(NH4)2CO3任写一个) 饱和碳酸氢钠 除去HCl Na2SiO3 SiO32-+CO2+H2O=H2SiO3+CO32- HCl H2CO3 H2SiO3
【解析】
根据较强酸制取较弱酸可知,要想验证HCl、H2CO3、H2SiO3的酸性强弱,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,根据实验现象确定酸的相对强弱。
(1)A中碳酸盐与盐酸反应放出二氧化碳气体,可证明酸性HCl>H2CO3,所以锥形瓶A中装可溶性正盐溶液,其化学式可能为Na2CO3(或K2CO3、(NH4)2CO3任写一个);
(2)由于盐酸具有挥发性,装置B的作用是除去二氧化碳中的氯化氢,盛放的试剂是饱和碳酸氢钠;
(3)要证明碳酸酸性大于硅酸,装置C所盛试剂溶质的化学式是Na2SiO3。C中反应的离子方程式是SiO32-+CO2+H2O=H2SiO3+CO32-;
(4)根据较强酸制取较弱酸可知,用盐酸和碳酸盐反应制取二氧化碳,用二氧化碳和硅酸钠溶液制取硅酸,由此可得出的结论是:酸性HCl>H2CO3>H2SiO3。

练习册系列答案
相关题目