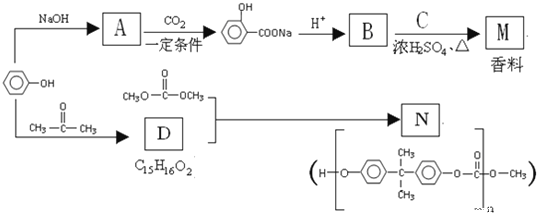
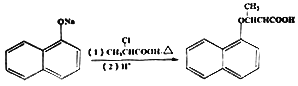
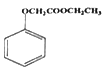
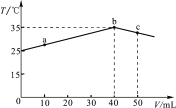
题目内容
【题目】下表是元素周期表的一部分,请回答有关问题:
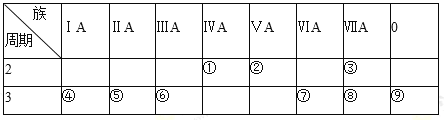
(1)①的元素符号为 _________;⑨的原子结构示意图为 _________。
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是_____________________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是_________(用化学式表示)。
(5)⑤、⑥两种元素相比较,金属性较强的是_________(填元素名称),可以验证这一结论的实验是_________(填正确选项的编号)。
A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
【答案】 C 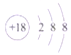 Cl HF HClO4 镁 BC Al(OH)3+OH-=AlO2-+2H2O
Cl HF HClO4 镁 BC Al(OH)3+OH-=AlO2-+2H2O
【解析】由元素在周期表中的位置可知,①是C、②是N、③是F、④是Na、⑤是Mg、⑥是Al、⑦是S、⑧是Cl、⑨是Ar。
(1)①的元素符号为C;⑨的原子结构示意图为 ,故答案为:C;
,故答案为:C; ;(2)同周期元素从左到右,原子半径逐渐减小,第3周期主族元素中,原子半径最小的是Cl,故答案为:Cl;
;(2)同周期元素从左到右,原子半径逐渐减小,第3周期主族元素中,原子半径最小的是Cl,故答案为:Cl;
(3)元素的非金属性越强,气态氢化物越稳定,表中元素的气态氢化物中最稳定的是HF,故答案为:HF;
(4)元素的非金属性越强,最高价氧化物的水化物中酸性越强,①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是HClO4,故答案为:HClO4;
(5)同周期元素从左到右,金属性逐渐减弱,⑤、⑥两种元素相比较,金属性较强的是镁。A.金属性的强弱能够用金属与碱的反应来判断,故A错误;B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,说明金属性越强,故B正确;C.将形状、大小相同这两种元素的单质分别和热水作用,并滴入酚酞溶液,溶液碱性越强,说明金属性越强,故C正确;故选BC;
(6)氢氧化铝与氢氧化钠反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O。

 阅读快车系列答案
阅读快车系列答案