题目内容
下列表述与化学用语正确的是
A.CO2的比例模型 |
B.氢化铵的电子式: 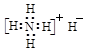 |
C.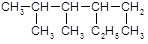 的名称:2,3-二甲基-4-乙基己烷 的名称:2,3-二甲基-4-乙基己烷 |
D.乙酸乙酯水解: |
C
解析试题分析:A、C原子半径大于O原子,错误;B、H-的电子式为[:H]-,错误;C、正确;D、乙酸乙酯水解: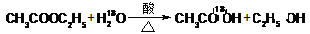 ,错误。
,错误。
考点:比例模型、电子式、有机物的命名、性质知识。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
| B.常温下,l L pH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为
| A.3:4:1 | B.3:3:2 | C.6:7:3 | D.6:9:0 |
将2molNaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为
| A.1mol<n≤2mol | B.1mol<n≤4mol |
| C.2mol<n≤4mol | D.n>4mol |
设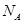 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A.1.7gH2O2中含有的中子数目为0.9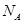 |
B.1molNa2O2固体中含离子总数为4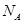 |
C.标准状况下,0.1molCl2溶于水,转移电子数目为0.1 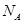 |
D.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1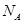 |
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为
| A.6 :3 :2 | B.3 :2 :1 | C.6 :3 :1 | D.1 :2 :3 |
下列化学用语正确的是
A.NH4Cl的电子式: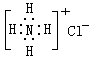 | B.S2—的结构示意图: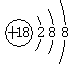 |
| C.乙醇的分子式:CH3CH2OH | D.原子核内有8个中子的碳原子: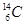 |
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |