题目内容
下列有关甲醛的化学用语表达错误的是
| A.结构简式:HCHO | B.最简式:CH2O |
C.比例模型: | D.电子式: |
D
解析试题分析:电子式中C与O之间共用两对电子
考点:化学用语

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列化学用语正确的是
A.NH4Cl的电子式: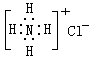 | B.S2—的结构示意图: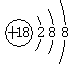 |
| C.乙醇的分子式:CH3CH2OH | D.原子核内有8个中子的碳原子: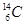 |
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。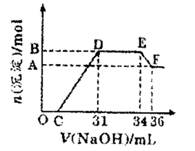
分析上述图形,下列说法不正确的是
| A.OC段离子反应方程式:H+十OH-=H2O |
| B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
| C.溶液中n(NH4+)=0.012mol |
| D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.1mol SiO2中含有NA个SiO2分子 |
| B.1mol Cu与足量的稀HNO3反应,转移2 NA个电子 |
| C.1 L0.1mol . L-1Na2CO3溶液中含有 0.1NA个CO32- |
| D.1mol苯乙烯中含有的碳碳双键数为4NA |
镁铝碱式盐对工业污水中的铬有良好吸附性。取该碱式盐0.7525g,滴加1.0mol/L盐酸,当加盐酸21.25mL时开始产生CO2气体,加入盐酸至22.50mL时恰好反应完全,向该溶液中加入过量氢氧化钠溶液,过滤,沉淀物进行干燥后重0.4350g。则该碱式盐的化学式是
| A.Al2Mg6(OH)16CO3?4H2O | B.Al4Mg12(OH)34CO3?8H2O |
| C.Al2Mg4(OH)16CO3?4H2O | D.Al3Mg6(OH)34CO3?8H2O |
将3.52 g CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48 g | B.7.48 g | C.5.72 g | D.5.22g |
常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | | 2NA |
| B. | 11.2L | 1mol | |
| C. | | 63g | 2mol |
| D. | | 1mol | NA |
设NA为阿伏加德罗常数的值。下列叙述错误的是
| A.常温常压下,0.17g NH3中含有的共用电子对数为0.1NA |
| B.常温常压下,1 L pH=1的稀H2SO4中含有的氢离子数为0.1NA |
| C.标准状况下,2.24 L C12与足量稀NaOH反应转移电子数为0.1NA |
| D.10 g由CaCO3与KHCO3组成的混合物中含有的碳原子数为0.1NA |