题目内容
能大量存在于同一溶液中,当改变条件使水电离出的时c(H+)= mol/L,一定会发生反应的离子组是
mol/L,一定会发生反应的离子组是
A
解析试题分析:室温下,KW=C(H+)·C(OH-)=1.0×10-14, C(H+)=C(OH-)=1.0×10-7, 当改变条件使水电离出的时c(H+)=10-13 mol/L,说明水的电离受到了抑制,根据电离平衡H2O H++OH-可知:可能外加了酸或碱。若溶液呈酸性,则发生反应:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O. 若溶液呈碱性,则发生反应: Fe2++2OH-= Fe(OH)2↓因此无论是酸性环境还是碱性环境一定会发生反应。正确。B.微粒之间会发生反应:Ca2++CO32-= CaCO3↓.不能共存,错误。C.这些微粒能共存于同一溶液,在酸性环境不发生反应液可以共存,在碱性环境会发生反应:Cu2++2OH-= Cu(OH)2↓。错误。D.微粒会发生反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑.错误。
H++OH-可知:可能外加了酸或碱。若溶液呈酸性,则发生反应:3Fe2++4H++NO3-= 3Fe3++NO↑+2H2O. 若溶液呈碱性,则发生反应: Fe2++2OH-= Fe(OH)2↓因此无论是酸性环境还是碱性环境一定会发生反应。正确。B.微粒之间会发生反应:Ca2++CO32-= CaCO3↓.不能共存,错误。C.这些微粒能共存于同一溶液,在酸性环境不发生反应液可以共存,在碱性环境会发生反应:Cu2++2OH-= Cu(OH)2↓。错误。D.微粒会发生反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑.错误。
考点:考查关于溶液中的离子共存的问题的知识。

 阅读快车系列答案
阅读快车系列答案在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是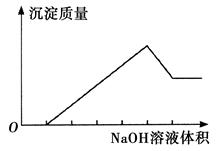
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列离子方程式书写正确的是( )
A.碳酸钠溶液滴入酚酞变红: CO32- + 2H2O 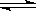 H2CO3 + 2OH- H2CO3 + 2OH- |
| B.铜溶解于氯化铁溶液中:2Fe3++3Cu=2Fe+3Cu2+ |
| C.氯化铝溶液与过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| D.FeSO4溶液中滴入稀硝酸:3Fe2+ + 4H+ + NO3- = 3Fe3+ + 2H2O + NO↑ |
在溶液中加入过量Na2O2后仍能大量共存的离子组是
| A.Fe2+、NH4+、Cl-、NO3- | B.K+、CO32-、Cl-、SO42- |
| C.Ca2+、Na+、NO3-、HCO3- | D.Na+、H+、Cl-、Br- |
某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。 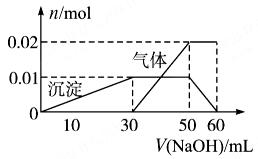
下列说法不符合事实的是( )
| A.根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L |
| B.根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L |
| C.另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀 |
| D.NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3 |
已知I2+SO32—+H2O==2I—+SO42—+2H+。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
| A.②③④ | B.①②③ | C.①③ | D.①② |
在水溶液中能大量共存的一组离子是
| A.Na+、Al3+、Cl-、CO32- | B.K+、NH4+、OH-、SO42 |
| C.Na+、Ba2+、Cl—、NO3— | D.H+、Na+、Fe2+、MnO4- |
下列反应的离子方程式书写正确的是
| A.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O |
| B.碳酸钙溶于醋酸:CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O |
| C.向硅酸钠溶液中通入过量的CO2:SiO32-+ CO2 + H2O= H2SiO3↓+ CO32- |
| D.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-="=" CaCO3↓+H2O |
 Al(OH)3
Al(OH)3