��Ŀ����
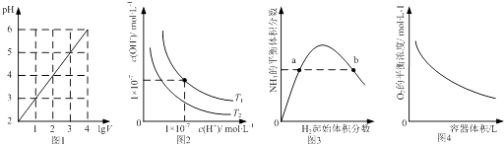
����Ŀ��ʵ���������Ƶ�ˮ�������ǽ�I2����KI��Һ�У������Ϳ��Եõ�Ũ�Ƚϴ�ĵ�ˮ����Ҫ����Ϊ�����˷�Ӧ��I2(aq)+ I![]()
![]()
����ƽ����ϵ�У�![]() �����ʵ���Ũ��c(
�����ʵ���Ũ��c(![]() )���¶�T�Ĺ�ϵ��ͼ��ʾ(�����ϵ��κ�һ�㶼��ʾƽ��״̬)��
)���¶�T�Ĺ�ϵ��ͼ��ʾ(�����ϵ��κ�һ�㶼��ʾƽ��״̬)��

��1��ͨ��������ͼ���÷�Ӧ������ӦΪ ��Ӧ(����ȡ����ȡ�)��
��2����T1�¶�D״̬ʱ��v�� v��(�>����<����=��)������T1ʱij״̬![]() =
=![]() �� ƽ��״̬(��ǡ������ǡ���һ���ǡ�)��
�� ƽ��״̬(��ǡ������ǡ���һ���ǡ�)��
��3��д����ƽ�ⳣ���ı���ʽK = ���������¶ȣ�Kֵ�� (�����С�����䡱����ͬ)��������Һ�м�����������ˮ��Kֵ�� ��
���𰸡���1������ ��2�� �� ��һ���� ��3��![]() ��С ����
��С ����
����������1�������⼰ͼ��֪��I2(aq)+I-![]()
![]() �������¶ȣ�c(
�������¶ȣ�c(![]() )��С��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�� ��2����T1�¶�D״̬ʱ��Ҫ�ﵽƽ��״̬A�㣬c(
)��С��ƽ�����淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ�� ��2����T1�¶�D״̬ʱ��Ҫ�ﵽƽ��״̬A�㣬c(![]() )������Ӧ������У���v����v����K=
)������Ӧ������У���v����v����K=![]() ����
����![]() =
=![]() ʱ����֪c(I2)�Ĵ�С������ȷ���Ƿ�ﵽƽ��״̬��
ʱ����֪c(I2)�Ĵ�С������ȷ���Ƿ�ﵽƽ��״̬��
��3��K=![]() �������¶ȣ�ƽ�������ƶ�����Kֵ��С��������������ˮ��ֻ�ı������ʵ�Ũ�ȣ���Kֵ���䡣
�������¶ȣ�ƽ�������ƶ�����Kֵ��С��������������ˮ��ֻ�ı������ʵ�Ũ�ȣ���Kֵ���䡣

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ