��Ŀ����
����Ŀ����֪ij�¶��£�Ksp��AgCl��=1.56��10��10 �� Ksp��Ag2CrO4��=1��10��12 �� ���й��ڸ��¶��µ�������ȷ���ǣ� ��
A.���Ȼ���������Һ�м����Ȼ�����Һ��Ksp��AgCl�� ��С
B.����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+����
C.����0.0008 molL��1��K2CrO4��Һ�м�������0.002 molL��1��AgNO3��Һ����CrO42����ȫ��������ʾ��������ȫc��CrO42������10��5 molL��1��
D.����0.001 molL��1 AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001 molL��1��KCl��K2CrO4�����Һ�У����Ȳ���AgCl����
���𰸡�D
���������⣺A���¶Ȳ��䣬��Ksp���䣬��A����
B������AgCl��Һ��c2��Ag+��=Ksp��AgCl��=1.56��10��10 �� ����Ag2CrO4��Һ�� ![]() =Ksp��Ag2CrO4��=1��10��12 �� ��Ȼ���ߵ�c��Ag+����B����
=Ksp��Ag2CrO4��=1��10��12 �� ��Ȼ���ߵ�c��Ag+����B����
C������Һ��Ϻ���c��K2CrO4��=0.0004 mol/L��c��AgNO3��=0.001 mol/L������2Ag++CrO42��=Ag2CrO4��������Һ��ʣ���c��Ag+��=0.001��0.0004��2=0.0002 mol/L������Ksp��K2CrO4���������ɳ��������Һ��c��CrO42����= ![]() =
= ![]() =2.5��10��5mol/L��1.0��10��5mol/L����Һ�д�����������ܽ�ƽ�⣬����CrO42��������ȫ��������C����
=2.5��10��5mol/L��1.0��10��5mol/L����Һ�д�����������ܽ�ƽ�⣬����CrO42��������ȫ��������C����
D����Cl����ʼ����ʱc��Ag+��= ![]() =1.8��10��7mol/L����CrO42����ʼ����ʱ����Ag+��=
=1.8��10��7mol/L����CrO42����ʼ����ʱ����Ag+��= ![]() =4.36��10��5 mol/L����AgCl��Һ��c��Ag+���ȱ���Ag2CrO4��Һ��c��Ag+��С������ͬŨ�ȵ�KCl��K2CrO4�����Һ�е���AgNO3��Һ��������AgCl��������D��ȷ��
=4.36��10��5 mol/L����AgCl��Һ��c��Ag+���ȱ���Ag2CrO4��Һ��c��Ag+��С������ͬŨ�ȵ�KCl��K2CrO4�����Һ�е���AgNO3��Һ��������AgCl��������D��ȷ��
��ѡD��
A��AgCl��Kspֻ���¶��йأ������ӵ�Ũ���أ�
B������AgCl��Һ��c2��Ag+��=Ksp��AgCl��=1.56��10��10 �� ����Ag2CrO4��Һ�� ![]() =Ksp��Ag2CrO4��=1��10��12 �� �ɴ˷������
=Ksp��Ag2CrO4��=1��10��12 �� �ɴ˷������
C���������߷�Ӧ��Ȼ�����ʣ�������ӣ�����ܶȻ���CrO42�����ӵ�Ũ����1.0��10��5mol/L�Ƚϣ�
D������Ksp��AgCl����Ksp��Ag2CrO4�������㵱Cl����CrO42����ʼ����ʱc��Ag+����

����Ŀ�������йط�Ӧ�ȵ���������ȷ���ǣ� ��
����֪2H2��g��+O2��g���T2H2O��g����H=��483.6kJmol��1 �� ��������ȼ����Ϊ��H=��241.8kJmol��1
���ɵ���Aת��Ϊ����B��һ�����ȹ��̣��ɴ˿�֪����B�ȵ���A�ȶ�
��X��g��+Y��g���TZ��g��+W��s����H��0�����º��������´ﵽƽ������X��������Ӧ�ġ�H����
����֪��
���ۼ� | C��C | C�TC | C��H | H��H |
����/��kJmol��1�� | 348 | 610 | 413 | 436 |
�ϱ����ݿ��Լ���� ![]() ��g��+3H2��g����
��g��+3H2��g���� ![]() ��g���ķ�Ӧ�ȣ�
��g���ķ�Ӧ�ȣ�
���ɸ�˹���ɣ���֪����ͬ�����£����ʯ��ʯīȼ������1molCO2����ʱ���ų���������ȣ�
��25�棬101kPaʱ��1mol̼��ȫȼ������CO2���ų�������Ϊ̼��ȼ���ȣ�
A.�٢ڢۢ�
B.�ۢܢ�
C.�ܢ�
D.��
����Ŀ�����й������ʵķ��������ȷ����( )
������� | �� | �� | �� | �ǽ��������� | ���������� |
A. | C2H5OH | Ca(OH)2 | K2CO3 | CO2 | CaO |
B. | HNO3 | NaHCO3 | Na2SO4 | CuO | MgO |
C. | NH3 | Ba(OH)2 | MgCl2 | P2O5 | CaO |
D. | CH3COOH | NaOH | CaCO3 | SO2 | Mn2O7 |
A.AB.BC.CD.D
����Ŀ����������������Ӧ����㷺�Ľ����������������ܹ�ע����֪��
��2Fe2O3��s��+3C��s��4Fe��s��+3CO2��g����H=+460.5KJmol��1
��Fe2O3��s��+3CO��g��2Fe��s��+3CO2��g����H=��28.5KJmol��1
�۶���1mol CO��s�������еĻ�ѧ����Ҫ����1076KJ������
����1mol CO2��s�������еĻ�ѧ����Ҫ����1490KJ������
��ش�
��1������1mol C��s�������л�ѧ����Ҫ���յ�����Ϊ ��
��2��T1��ʱ�����ܱ������м���һ������Fe2O3��C��������Ӧ�٣��ﵽƽ���CO2��Ũ��Ϊa molL��1�������������䣬��С�����ݻ����ٴδﵽƽ��ʱ��CO2��Ũ��Ϊb molL��1 �� ��a��ѡ�������������=����b��
��3����ʼ�¶Ⱦ�ΪT2��ʱ�����ݻ�Ϊ10L�����������ܱ������У��ֱ����һ������Fe2O3��CO������Ӧ�ڣ����������������ʾ��
��� | ���� | ��ʼʱ���ʵ��� mol | ƽ��ʱ���ʵ���/mol | ƽ�ⳣ����K�� | |
Fe2O3 | CO | Fe | |||
1 | ���� | 0.5 | 1.5 | 0.8 | K1 |
2 | ���� | 2 | 3 | m | K2 |
3 | ���� | 1 | 1.5 | n | K3 |
��T2��ʱ������1�з�Ӧ��ƽ�ⳣ��K1= ��
������2�У�5min�ﵽƽ�⣬��0��5min����CO2��ʾ�÷�Ӧ������v��CO2��= ��
�۶������������еķ�Ӧ������˵����ȷ��������ѡ����ĸ����
A��m��2n
B������1������2��CO��ƽ��ת����v1��v2 ��
C��K1=K3
D��ƽ��ʱ����ѹǿ��P3��P1
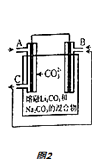
��4��T2��ʱ�����ѹ�ܱ������г���0.5mol Fe2O3��1.0mol CO��������Ӧ�ڣ�CO��CO2�����ʵ���Ũ�ȣ�c����ʱ�䣨t���Ĺ�ϵ��ͼ1��ʾ�� 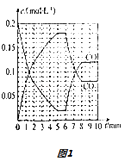
��6minʱ���ı���������δ �� ����Ϊ ��
��10minʱ�����������м���1 mol Fe2O3��1 mol CO��1 mol Fe��1 mol CO2����ʼ�ķ�Ӧ����v��������ѡ�������������=����v���棩��
��5��CO��O2������ȼ�ϵ�ص�װ����ͼ2��ʾ����ع���ʱ��C�ڲ���������һ����ͨ��B�ڱ����ã���һ���ֱ����������������������2mole�� �� ������C�ڱ����������������ʵ������Ϊ ��