题目内容
【题目】氧化与还原在同一元素中进行的是
A.Cl2+2NaOH![]() NaCl+NaClO+H2O B.Fe+CuSO4
NaCl+NaClO+H2O B.Fe+CuSO4![]() FeSO4+Cu
FeSO4+Cu
C.2H2O![]() 2H2↑+O2↑ D.2KClO3
2H2↑+O2↑ D.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
【答案】A
【解析】A.在反应Cl2+2NaOH![]() NaCl+NaClO+H2O中,氯元素的化合价既有升高,也有降低,因此是同一元素的氧化还原反应,正确;B.在反应Fe+CuSO4
NaCl+NaClO+H2O中,氯元素的化合价既有升高,也有降低,因此是同一元素的氧化还原反应,正确;B.在反应Fe+CuSO4![]() FeSO4+Cu中,Fe是还原剂,硫酸铜是氧化剂,发生氧化还原反应的元素是不同的元素,错误;C.在该反应中发生氧化的元素是O元素,发生还原反应的元素是H元素,因此是不同的元素之间的氧化还原反应,错误;D.在反应2KClO3
FeSO4+Cu中,Fe是还原剂,硫酸铜是氧化剂,发生氧化还原反应的元素是不同的元素,错误;C.在该反应中发生氧化的元素是O元素,发生还原反应的元素是H元素,因此是不同的元素之间的氧化还原反应,错误;D.在反应2KClO3![]() 2KCl+3O2↑中发生氧化的元素是O元素,发生还原的元素是Cl元素,是不同的元素之间的氧化还原反应,错误。
2KCl+3O2↑中发生氧化的元素是O元素,发生还原的元素是Cl元素,是不同的元素之间的氧化还原反应,错误。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

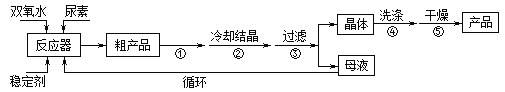
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。





