题目内容
3.下列微粒中,最外层未成对电子数最多的是( )| A. | O | B. | P | C. | Si | D. | Fe3+ |
分析 根据能量最低原理书写各元素的电子排布式,根据电子排布式判断未成对电子数,可解答该题.
解答 解:A.O的电子排布式为1s22s22p4,未成对电子数为2;
B.P的电子排布式为1s22s22p63s23p3,未成对电子数为3;
C.Si的电子排布式为1s22s22p63s23p2,未成对电子数为2;
D.Fe3+电子排布式为1s22s22p63s23p63d5,未成对电子数为5;
比较可知Fe3+的未成对电子数为5,最多,
故选D.
点评 本题考查原子核外电子的排布,题目难度中等,注意根据电子排布式判断未成对电子数.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案
相关题目
7.消除氮氧化物和硫氧化物有多种方法.
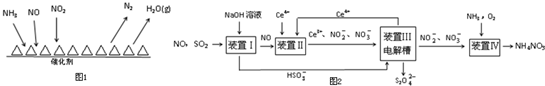
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图可知SCR技术中的氧化剂为NO、NO2.
②用Fe做催化剂时,在氨气足量的情况下,当$\frac{c(N{O}_{2})}{c(NO)}$=1:1时,脱氮率最佳,已知每生成28g N2 放出的热量为QkJ,该反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol.
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为SO2+OH-=HSO3-.
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,理论上可再生8mol Ce4+.
Ⅲ.用活性炭还原法可以处理氮氧化物.如发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2(答一种即可).
Ⅰ.NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图1所示:
①由图可知SCR技术中的氧化剂为NO、NO2.
②用Fe做催化剂时,在氨气足量的情况下,当$\frac{c(N{O}_{2})}{c(NO)}$=1:1时,脱氮率最佳,已知每生成28g N2 放出的热量为QkJ,该反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H=-2QkJ/mol.
Ⅱ.工业上变“废”为宝,吸收工业中SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如图2(Ce为铈元素):
①装置Ⅰ中的主要反应的离子方程式为SO2+OH-=HSO3-.
②装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1mol CH4时,理论上可再生8mol Ce4+.
Ⅲ.用活性炭还原法可以处理氮氧化物.如发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2(答一种即可).

14.过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2,过氧化钙可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等,是一种重要化工试剂.
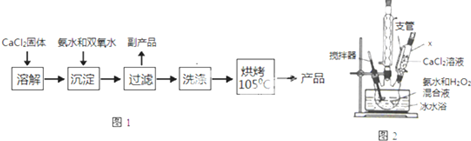
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
(6)测得CaO2纯度偏低的原因可能是AD
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.

(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
11.不能实现下列物质间直接转化的元素是( )单质→氧化物→氧化物→酸或碱.
| A. | 碳 | B. | 氮 | C. | 硫 | D. | 铝 |
18.反应3Cl2+8NH3═6NH4Cl+N2中,如果有0.6mol电子转移,则被氧化的氨的质量是( )
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
8.下列分子中的中心原子的杂化方式为sp杂化,分子的空间构型为直线形且分子中没有形成π键的是( )
| A. | C2H2 | B. | BeCl2 | C. | CO2 | D. | HClO |
12.下列说法正确的是( )
| A. | 所有主族元素的最高正化合价都等于其最外层电子数 | |
| B. | 所有过渡元素都是金属元素,所有的金属元素也都是过渡元素 | |
| C. | 在周期表中氧族元素的单质全部是气体 | |
| D. | 同周期主族元素的原子半径以ⅦA族的为最小 |
 .
.