题目内容
15.氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示: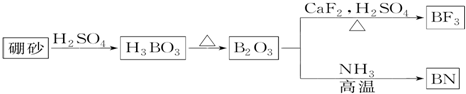
请回答下列问题:
(1)由B2O3制备BN的化学方程式是B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)B和N相比,电负性较大的是N,BN中B元素的化合价为+3;
(3)在BF3分子中,F-B-F的键角是120°,B原子的杂化轨道类型为sp2杂化;
(4)BF3和过量NaF作用可生成NaBF4,BF${\;}_{4}^{-}$的立体构型为正四面体;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为共价键,N原子L层的P电子比S电子多1个.
(6)写出CaF2的电子式:
 .
.
分析 (1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成;
(2)同周期从左到右电负性依次增强,B第IIIA族元素,为+3价;
(3)价层电子对互斥理论认为:分子的立体构型是“价层电子对”相互排斥的结果,先判断价层电子对数,再确定构型和杂化方式;
(4)价层电子对互斥理论判断其σ电子对和孤电子对数目;
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,氮原子的外围电子排布为1s22s22p3;
(6)氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边.
解答 解(1)由工艺流程可知,B2O3与NH3反应生成BN,根据原子守恒可知,还有水生成,反应方程式为:B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O,
故答案为:B2O3+2NH3$\frac{\underline{\;高温\;}}{\;}$2BN+3H2O;
(2)同周期从左到右电负性依次增强,所以电负性N>B;B第ⅢA族元素,为+3价;
故答案为:N;+3;
(3)BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(0-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形,键角是120°,BF3分子的中心原子B原子的价层电子对数为;3,属于sp2杂化,
故答案为:120°;sp2杂化;
(4)BF3和过量NaF作用可生成NaBF4,BF4-中B原子的价层电子对=4+$\frac{1}{2}$=4,该离子中不含孤电子对,为正四面体结构,故答案为:正四面体;
(5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为共价键,氮原子的外围电子排布为1s22s22p3;所以N原子L层的P电子比S电子多4-3=1,故答案为:共价键;1;
(6)氟化钙为离子化合物,钙离子直接用离子符号Ca2+表示,氟离子需要标出其最外层电子及所带电荷,两个氟离子需要先在钙离子的两边,氟化钙的电子式为: ,故答案为:
,故答案为: .
.
点评 本题考查结构性质位置关系、核外电子排布规律、杂化轨道、电负性等,题目综合性较大,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 三角锥形、sp3 | B. | V形、sp2 | C. | 平面三角形、sp2 | D. | 三角锥形、sp2 |
| A. | Cl2溶于水 | B. | NH3溶于水 | C. | CO2溶于水 | D. | SO2溶于水 |
| A. | O | B. | P | C. | Si | D. | Fe3+ |
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一种强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
| A. | 溴苯(液溴),加四氯化碳、萃取 | |
| B. | 乙烷(乙烯),通入高锰酸钾溶液、洗气 | |
| C. | 溴乙烷(乙醇),加水振荡、分液 | |
| D. | 乙酸乙酯(乙酸),加氢氧化钠溶液振荡、分液 |

 ,该反应的类型为酯化反应.
,该反应的类型为酯化反应. .
. .
.