题目内容
18.反应3Cl2+8NH3═6NH4Cl+N2中,如果有0.6mol电子转移,则被氧化的氨的质量是( )| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
分析 该反应中Cl元素化合价由0价变为-1价、部分N元素化合价由-3价变为0价,有$\frac{1}{4}$的氨气参加氧化反应,转移电子个数为6,根据转移电子和被氧化氨的关系式计算.
解答 解:该反应中Cl元素化合价由0价变为-1价、部分N元素化合价由-3价变为0价,有$\frac{1}{4}$的氨气参加氧化反应,转移电子个数为6,即有2mol氨气参加氧化反应则有6mol电子转移,则如果有0.6mol电子 发生转移,则被氧化氨的物质的量为0.2mol,被氧化氨气的m(NH3)=0.2mol×17g/mol=3.4g,故选A.
点评 本题考查氧化还原反应的计算,侧重考查分析计算能力,明确参加氧化反应的氨气与转移电子之间的关系是解本题关键,注意并不是所有氨气都参加氧化反应,为易错点.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
2.如图所示信息判断,下列离子能够大量共存的一组是( )
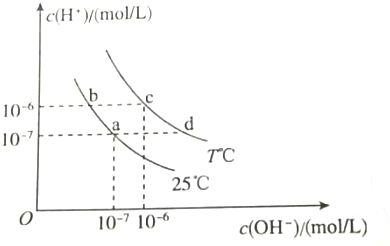

| A. | a点对应的溶液中:Al3+、Na+、Cl-、CO32- | |
| B. | b点对应的溶液中:K+、Ba2+、NO3-、AlO2- | |
| C. | c点对应的溶液中:Fe3+、Na+、I-、SO42- | |
| D. | d点对应的溶液中:Na+、K+、SO32-、Cl- |
6.下列气体溶于水时,发生了氧化还原反应的是( )
| A. | Cl2溶于水 | B. | NH3溶于水 | C. | CO2溶于水 | D. | SO2溶于水 |
13.工业上常用FeSO4制备Fe2O3,反应方程式为:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,若将生成的气体通入足量的氯化钡和氨水的混合溶液中,得到的沉淀物是( )
| A. | BaSO3和BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO4 |
3.下列微粒中,最外层未成对电子数最多的是( )
| A. | O | B. | P | C. | Si | D. | Fe3+ |
10.共价键是有饱和性和方向性的,下列有关叙述不正确的是( )
| A. | 共价键的饱和性是由成键原子的未成对电子数决定的 | |
| B. | 共价键的方向性是由成键原子的轨道的方向性决定的 | |
| C. | 共价键的饱和性决定了分子内部的原子的数量关系 | |
| D. | 共价键的饱和性与原子轨道的重叠程度有关 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- | |
| C. | 使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
