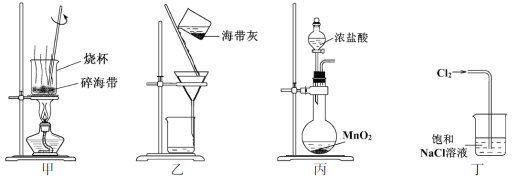
题目内容
【题目】(1)甲烷重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变ΔH(kJ·mol-1) |
甲烷 氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | ΔH1 |
CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | |
蒸汽 重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | +206.2 |
CH4(g)+2H2O(g)=CO2(g)+4H2(g) | +165.0 |
①反应CO(g)+H2O(g)=CO2(g)+H2(g)的ΔH=________kJ·mol-1。
②甲烷的燃烧热为ΔH2,则ΔH2________ΔH1(填“>”“=”或“<”)。
(2)二氧化碳是地球温室效应的罪魁祸首,目前人们处理二氧化碳的方法之一是使其与氢气合成为甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1 ①
CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1 ②
写出二氧化碳与氢气合成甲醇液体的热化学方程式:___________。
(3)有科技工作者利用稀土金属氧化物作为固体电解质制造出了甲醇空气燃料电池。这种稀土金属氧化物在高温下能传导O2-。
①这个电池的正极发生的反应是_______;负极发生的反应是________。
②在稀土氧化物的固体电解质中,O2-的移动方向是________。
【答案】-41.2 < CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol O2+4e-=2O2- CH3OH+3O2--6e-=CO2↑+2H2O 正极移向负极
【解析】
(1)根据盖斯定律,由蒸汽重整的两个反应方程式叠加,就可得到待求的热反应方程式。反应物能量相等,生成物含有的能量越多,反应放出的热量就越少。
(2)将两个热化学方程式叠加,可得二氧化碳与氢气合成甲醇液体的热化学方程式;
(3)①燃料电池中依据原电池工作原理,正极是氧气得到电子发生还原反应,电解质是固体,氧气得到电子生成氧离子;甲醇在负极失电子,发生氧化反应生成二氧化碳;
②原电池中阴离子移向负极。
(1)由蒸汽重整的两个反应
①CH4(g)+H2O(g)=CO(g)+3H2(g),ΔH=+206.2kJ/mol
②CH4(g)+2H2O(g)=CO2(g)+4H2(g),ΔH=+165.0kJ/mol
根据盖斯定律②-①,整理可得反应:CO(g)+H2O(g)=CO2(g)+H2(g),△H=165.0kJ/mol-206.2kJ/mol=-41.2kJ/mol;
甲烷的燃烧热是1mol甲烷完全燃烧产生CO2气体和液态水时放出的热量,由于等质量的气态水含有的能量比液态水多,所以1mol甲烷反应产生液态水放出是热量比产生气态水放热多,反应放出的热量越多,反应热就越小,因此ΔH2<ΔH1;
(2)①2H2(g)+O2(g)=2H2O(l) ΔH=-570 kJ·mol-1
②CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-726.0 kJ·mol-1
根据盖斯定律①×![]() -②,整理可得CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol;
-②,整理可得CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=-129kJ/mol;
(3)①甲醇一空气燃料电池中,氧气在正极上得到电子,发生还原反应生成O2-,电极反应为:O2+4e-=2O2-;甲醇在负极失电子发生氧化反应,电极反应为:CH3OH+3O2--6e-=CO2↑+2H2O;
②依据电极反应分析可知原电池中阴离子移向负极,O2-从正极流向负极移动。

 小题狂做系列答案
小题狂做系列答案