题目内容
6.(1)1.5molH2SO4中所含H+的物质的量为3mol,硫酸根离子的物质的量为1.5mol,所含硫酸分子的数目为1.5NA.(2)1mol CO和0.5mol CO2所含氧原子数相等?
(3)0.5molH2O中共有1.5mol原子.
分析 (1)根据化学式知,n(H+)=2n(H2SO4)、n(SO42-)=n(H2SO4),硫酸分子个数=nNA;
(2)根据分子构成知,要使CO和CO2中O原子个数相等,则二者的物质的量之比为2:1;
(3)每个水分子中含有3个原子,原子物质的量=3n(H2O).
解答 解:(1)根据化学式知,n(H+)=2n(H2SO4)=2×1.5mol=3mol、n(SO42-)=n(H2SO4)=1.5mol,硫酸分子个数=nNA=1.5mol×NA/mol=1.5NA,
故答案为:3mol;1.5mol;1.5NA;
(2)根据分子构成知,要使CO和CO2中O原子个数相等,则二者的物质的量之比为2:1,则二氧化碳物质的量=$\frac{1}{2}$×n(CO)=$\frac{1}{2}$×1mol=0.5mol,故答案为:0.5;
(3)每个水分子中含有3个原子,原子物质的量=3n(H2O)=3×0.5mol=1.5mol,
故答案为:1.5.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量之间关系及分子构成是解本题关键,题目难度不大.

练习册系列答案
相关题目
1. 甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
 甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )
甲~己元素在周期表中的相对位置如图.甲是形成化合物种类最多的元素,乙比甲原子序数多6,丁、戊、己属同周期元素,下列判断错误的是( )| A. | 乙的单质在空气中燃烧生成的化合物只含离子键 | |
| B. | 丙可作半导体材料 | |
| C. | 丁与已核外电子数相差12 | |
| D. | 戊和己都不是主族元素,而是过渡元素 |
11.下列有关实验原理、操作或现象不正确的是( )
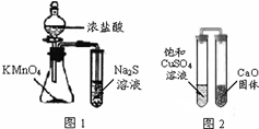

| A. | 下列有关实验原理、操作或现象不正确的是图1锥形瓶中滴入浓盐酸后充满黄绿色气体,试管中出现浅黄色浑浊 | |
| B. | 图2放置一段时间后,饱和CuSO4溶液中出现白色晶体 | |
| C. | 用玻璃棒蘸取某溶液做焰色反应实验,火焰呈黄色说明该溶液中不含钾元素 | |
| D. | 蒸馏时,将温度计水银球靠近蒸馏烧瓶支管口处 |
18.W、X、Y、Z 均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、6、8、8,它们的最外层电子数之和为10,下列说法正确的是( )
| A. | W 与Y 可以形成离子化合物 | |
| B. | X 的简单氢化物在同主族元素的氢化物中沸点最高,说明X 的非金属性最强 | |
| C. | X 和Z 形成的原子个数l:1 的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z 的熔融氧化物来制取Z 的单质 |
