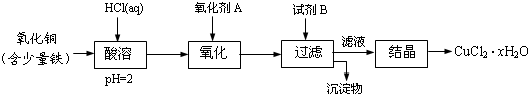
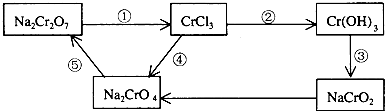
题目内容
4.下列叙述中,正确的是( )| A. | 同物质的量的NaCl和Cl2含有的分子数相等 | |
| B. | SO42-的摩尔质量是96g | |
| C. | 阿伏伽德罗常数约为6.02×1023mol-1 | |
| D. | 1摩尔氧气的质量等于NA个O2分子的相对分子质量 |
分析 A.NaCl由离子构成,不含分子;
B.摩尔质量的单位为g/mol;
C.阿伏伽德罗常数为NA,约为6.02×1023mol-1;
D.质量的单位为g,相对分子质量的单位为1.
解答 解:A.NaCl由离子构成,不含分子,氯气由分子构成,则相同物质的量时分子数不同,故A错误;
B.SO42-的摩尔质量是96g/mol,故B错误;
C.阿伏伽德罗常数为NA,约为6.02×1023mol-1,故C正确;
D.质量的单位为g,相对分子质量的单位为1,则1摩尔氧气的质量为32g,NA个O2分子的相对分子质量为32,二者不等,故D错误;
故选C.
点评 本题考查物质的量的计算,为高频考点,把握物质的量为中心的相关计算及物质构成为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
14.下列各组物质在适宜条件下反应,其中氧化剂与还原剂的物质的量之比为2:1的是( )
| A. | H2SO4(浓)+C | B. | Fe2O3+Al | C. | HNO3(浓)+C | D. | Fe2O3+CO |
15.下列物质的保存方法正确的是( )
| A. | 少量金属钠保存在冷水中 | |
| B. | 浓硝酸盛放在无色瓶中 | |
| C. | 少量白磷保存在煤油中 | |
| D. | 氢氧化钠溶液盛放在橡胶塞的试剂瓶中 |
12.下列说法不正确的是( )
| A. | 将某气体通入品红溶液中,品红溶液褪色,该气体不一定是SO2 | |
| B. | 因为亚硫酸的酸性强于碳酸,所以硫的非金属性比碳强 | |
| C. | 有些化学反应不属于化合、分解、置换、复分解中的任何一种反应 | |
| D. | 依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
19.某溶液中只大量含有如下离子中的X种:Cu2+、Mg2+、Na+、H+、Ba2+、Br-、OH-、CO32-,下列说法正确的是( )
| A. | 若溶液的pH>7,则X最多为5 | |
| B. | 若向溶液加入铝粉得到Al02-,则溶液中一定有Na+ | |
| C. | 若溶液有颜色,则溶液中一定有Cu2+、Br- | |
| D. | 若X=5,则溶液中一定有CO32- |
9.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 同浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4,其中c(NH4+)由大到小的顺序是:①>②>③>④ | |
| B. | 相同温度下,将足量氯化银固体分别放入相同条件的①蒸馏水、②0.1mol•L-1盐酸、③0.1mol•L-1氯化镁溶液、④0.1mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| C. | 常温下将NaHSO3和NaHCO3两溶液 混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(HSO3-)+c(HCO3-)+2c(CO32-)+2c(SO32-) | |
| D. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ |
16.下列有关实验基本操作正确的是( )
| A. | 实验室可以通过萃取、分液的方法将I2从其CCl4溶液中分离出来 | |
| B. | 从溶液中析出氯化钠晶体的常用方法是蒸发浓缩、冷却结晶 | |
| C. | 新配制的硫酸亚铁溶液中往往需加入少量铁锈 | |
| D. | 配制490mL 1mol•L-1的CuS04溶液需用500mL的容量瓶 |