题目内容
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2—、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是( )
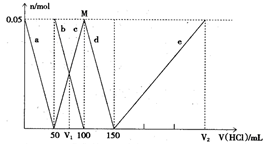

| A.原混合溶液中的CO32-与AlO2—的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0、05mol |
| D.a曲线表示的离子方程式为:AlO2—+H++H2O=Al(OH)3↓ |
D
由于酸性顺序是:H2CO3>HCO3->HAlO2,所以向混合溶液中滴加盐酸时,依次的离子反应为(各离子的物质的量[mol]的变化情况):
AlO2-+H++H2O=Al(OH)3↓
0.05 0.05 0.05
CO32-+H+=HCO3-
0.05 0.05 0.05
HCO3-+H+=CO2↑+H2O
0.05 0.05
Al(OH)3+3H+=Al3++3H2O
0.05 0.15
可看出,a曲线表示的是AlO2—的变化情况:AlO2—+H++H2O=Al(OH)3↓
b曲线表示的是CO32-逐渐减少的情况:CO32-+H+=HCO3-,同时,HCO3-增多,由c曲线表示
d曲线表示的是HCO3-的变化情况:HCO3-+H+=CO2↑+H2O
e曲线表示的是Al3+的变化情况:Al(OH)3+3H+=Al3++3H2O
很明显,V1是75ml,而V2是150+150=300ml,V1:V2=l:4
原混合溶液中的CO32-与AlO2—的物质的量均为0.05mol,比值为1:1
M点时根本就没有CO2气体的生成。
答案为D
AlO2-+H++H2O=Al(OH)3↓
0.05 0.05 0.05
CO32-+H+=HCO3-
0.05 0.05 0.05
HCO3-+H+=CO2↑+H2O
0.05 0.05
Al(OH)3+3H+=Al3++3H2O
0.05 0.15
可看出,a曲线表示的是AlO2—的变化情况:AlO2—+H++H2O=Al(OH)3↓
b曲线表示的是CO32-逐渐减少的情况:CO32-+H+=HCO3-,同时,HCO3-增多,由c曲线表示
d曲线表示的是HCO3-的变化情况:HCO3-+H+=CO2↑+H2O
e曲线表示的是Al3+的变化情况:Al(OH)3+3H+=Al3++3H2O
很明显,V1是75ml,而V2是150+150=300ml,V1:V2=l:4
原混合溶液中的CO32-与AlO2—的物质的量均为0.05mol,比值为1:1
M点时根本就没有CO2气体的生成。
答案为D

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 子的浓度如下表,则M离子可能为:
子的浓度如下表,则M离子可能为: