题目内容
7.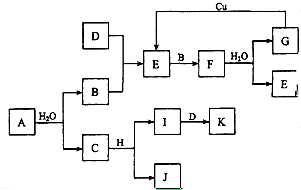 A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:
A~K为中学化学的常见物质,它们之间有如下图所示的转化关系(反应条件已略去).已知:通常状况下,A是淡黄色固体,B、D和I都是无色气体单质,F是红棕色气体,H是金属单质.回答下列问题:(1)写出化学式ANa2O2,FNO2,GHNO3,HAl,JNaA1O2,KNH3.
(2)写出实验室制取K的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)写出G→E的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;此反应中,氧化剂和还原剂的物质的量之比是2:3.0.3mol Cu完全反应,被还原的G为0.2molmol.
(4)检验C中阳离子的实验方法是焰色反应.
(5)实验室中保存的C溶液可能会变质,为了检验C溶液是否变质,分别取少量样品进行如下实验,其中能达到实验目的是ab(填序号).
a.向样品中滴加稀硝酸,观察现象
b.向样品中滴加氢氧化钡溶液,观察现象
c.向样品中滴加酚酞试液,观察现象
d.向样品中滴加氯化镁溶液,观察现象.
分析 通常状况下,A是淡黄色固体,能与水反应生成C及单质气体B,则A为Na2O2,B为O2,C为NaOH,H是金属单质,能与氢氧化钠溶液反应生成J与气体单质I,则H为Al、J为NaA1O2、I为H2.F是红棕色气体,则F为NO2,由E与氧气反应得到,则E为NO,气体单质D与氧气反应得到NO,则D为N2,K为NH3,二氧化氮与水反应生成G为NHO3,据此解答.
解答 解:通常状况下,A是淡黄色固体,能与水反应生成C及单质气体B,则A为Na2O2,B为O2,C为NaOH,H是金属单质,能与氢氧化钠溶液反应生成J与气体单质I,则H为Al、J为NaA1O2、I为H2.F是红棕色气体,则F为NO2,由E与氧气反应得到,则E为NO,气体单质D与氧气反应得到NO,则D为N2,K为NH3,二氧化氮与水反应生成G为NHO3,
(1)由上述分析可知,A为Na2O2,F为NO2,G为NHO3,H为Al,J为NaA1O2,K为NH3,
故答案为:Na2O2;NO2;HNO3;Al;NaA1O2;NH3;
(2)实验室用氢氧化钙与氯化铵反应制备氨气,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;
(3)G→E的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;此反应中,氧化剂为硝酸,由生成的NO可知,起氧化剂作用的硝酸占参加反应的$\frac{1}{4}$,还原剂为Cu,氧化剂与还原剂的物质的量之比是 2:3,根据反应可知,0.3mol Cu完全反应,被还原的硝酸为0.2mol,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2:3;0.2mol;
4)检验NaOH中钠离子的实验方法是:焰色反应,
故答案为:焰色反应;
(5)实验室中保存的NaOH溶液可能会变质,会含有碳酸钠,检验是否含有碳酸根即可确定是否变质,
a.若向样品变质,滴加稀硝酸会有气体生成,故a正确;
b.若样品变质,滴加氢氧化钡溶液,会有白色沉淀产生,故b正确;
c.氢氧化钠溶液呈碱性,碳酸钠溶液也呈碱性,向样品中滴加酚酞试液,无论是否变质,溶液都变为红色,故c错误;
d.氢氧化钠与氯化镁得到氢氧化镁沉淀,碳酸钠与氯化镁得到碳酸镁沉淀,向样品中滴加氯化镁溶液,无论是否变质都生成白色沉淀,故d错误,
故答案为:ab.
点评 本题考查无机物推断,物质的颜色及转化关系中特殊反应是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.

| A. | v(B)=0.075mol/(L•s) | B. | v(A)=0.030mol/(L•s) | C. | v(C)=0.040mol/(L•s) | D. | v(D)=0.060mol/(L•s) |
| A. | 室温时,在水电离出c(H+)=1.0×10-12mol•L-1的溶液中,K+、Na+、HCO3-、Cl-一定能大量共存 | |
| B. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,pH=2的醋酸溶液中所含有的H+数为0.01 NA | |
| D. | 将92 g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数大于NA |
| A. | CS2 | B. | CH4 | C. | CH3CH2Cl | D. | CH≡CH |

 ) 4种有机物分别在一定条件下与H2充分反应.
) 4种有机物分别在一定条件下与H2充分反应. 滴入溴水后,反应生成产物的结构简式为
滴入溴水后,反应生成产物的结构简式为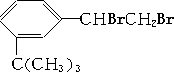 .
.