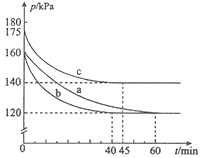
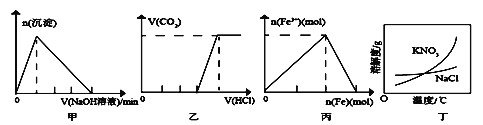
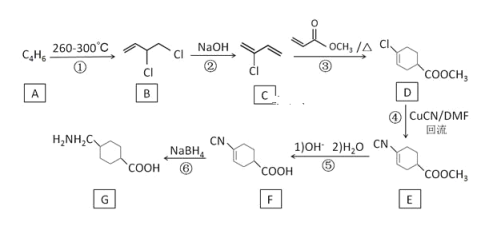
题目内容
【题目】(1)将Mg条放入浓NH4Cl溶液中产生无色气体,该气体是________(填化学式),请用离子方程式解释该现象产生的原因________________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)____________,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是____________。
【答案】H2 NH4++H2O![]() NH3·H2O+H+ Mg+2H+=Mg2++H2 ↑ Mg(OH)2(s)
NH3·H2O+H+ Mg+2H+=Mg2++H2 ↑ Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清。
Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清。
【解析】
(1) NH4Cl是强酸弱碱盐,在水中会发生水解,溶液显酸性,水解方程式为 NH4++H2O![]() NH3·H2O+H+;将Mg条放入浓NH4Cl溶液中,Mg与溶液中的H+反应生成氢气,离子反应方程式为Mg+2H+=Mg2++H2 ↑。本小题答案为:H2;NH4++H2O
NH3·H2O+H+;将Mg条放入浓NH4Cl溶液中,Mg与溶液中的H+反应生成氢气,离子反应方程式为Mg+2H+=Mg2++H2 ↑。本小题答案为:H2;NH4++H2O![]() NH3·H2O+H+ Mg+2H+=Mg2++H2 ↑。
NH3·H2O+H+ Mg+2H+=Mg2++H2 ↑。
(2)Mg(OH)2的溶解平衡方程式为Mg(OH)2(s)Mg2+(aq)+2OH(aq),向Mg(OH)2浊液中加入浓的NH4Cl溶液,一水合氨比氢氧化镁更难电离,所以铵根离子会结合氢氧根离子生成一水合氨,促使氢氧化镁逐渐溶解,离子方程式为 Mg(OH)2(s)+2 NH4+═Mg2++2NH3H2O。本小题答案为: Mg(OH)2(s) ![]() Mg2+(aq)+2OH-(aq) ;沉淀溶解,溶液澄清。
Mg2+(aq)+2OH-(aq) ;沉淀溶解,溶液澄清。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式 | 电离常数 |
HClO | K = 3×10-8 |
H2CO3 | K1 = 4×10-7 K2 = 6×10-11 |
A. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
B. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
C. 向Na2CO3溶液中滴加少量氯水:CO32-+2Cl2+H2O===2Cl-+2HClO+CO2↑
D. 向NaHCO3溶液中滴加少量氯水:2HCO3-+Cl2===Cl-+ClO-+2CO2↑+H2O