题目内容
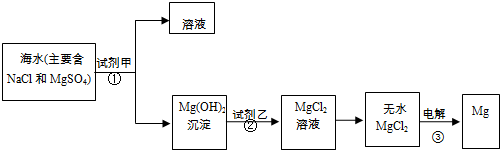
目前世界上60%的镁是从海水中提取的,某校学生设计从海水中提取镁的实验流程如下图.请思考并回答:
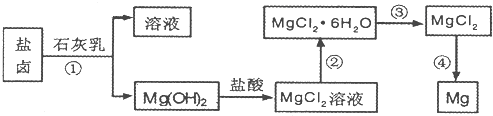
I.上述实验过程中涉及的①、②、③反应属于氧化还原反应的是
II.从海水中提取镁的过程中,为实现对镁离子的富集,有三种预设方案:
A.直接往海水中加沉淀剂;
B.加热蒸发海水后,加入沉淀剂;
C.利用晒盐后的苦卤水,加入沉淀剂.
通过分析比较,你认为方案
III.从海水中提取镁的过程中,另一重要的环节是实现对Mg2+的分离.
(1)为了使镁离子完全沉淀下来,若加入足量的试剂甲为澄清的石灰水,其反应的离子方程式为
(2)加入试剂甲后,能够分离得到Mg(OH)2沉淀的方法是

I.上述实验过程中涉及的①、②、③反应属于氧化还原反应的是
③
③
(填序号).II.从海水中提取镁的过程中,为实现对镁离子的富集,有三种预设方案:
A.直接往海水中加沉淀剂;
B.加热蒸发海水后,加入沉淀剂;
C.利用晒盐后的苦卤水,加入沉淀剂.
通过分析比较,你认为方案
C
C
正确(填序号),其理由是该方法因Mg2+浓度大,节约能源,成本较低
该方法因Mg2+浓度大,节约能源,成本较低
.III.从海水中提取镁的过程中,另一重要的环节是实现对Mg2+的分离.
(1)为了使镁离子完全沉淀下来,若加入足量的试剂甲为澄清的石灰水,其反应的离子方程式为
Mg2++2OH-=Mg(OH)2↓
Mg2++2OH-=Mg(OH)2↓
.(2)加入试剂甲后,能够分离得到Mg(OH)2沉淀的方法是
过滤
过滤
(填实验操作名称).分析:I.根据①、②、③反应的方程式以及化合价变化来判断;
II.根据三个观点的优点和缺点综合分析;
III.(1)根据镁离子能与氢氧根离子反应生成沉淀;
(2)根据固体不溶于水可用过滤的方法分离.
II.根据三个观点的优点和缺点综合分析;
III.(1)根据镁离子能与氢氧根离子反应生成沉淀;
(2)根据固体不溶于水可用过滤的方法分离.
解答:解:①的反应为MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,元素的化合价未变,不是氧化还原反应;
②的反应为:Mg(OH)2+2HCl=MgCl2+2H2O,元素的化合价未变,不是氧化还原反应;
③反应为:MgCl2
Mg+Cl2↑,元素的化合价发生了变化,是氧化还原反应;
故答案为:③;
II.A.直接往海水中加沉淀剂,因海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,故A错误;
B.加热蒸发海水后,加入沉淀剂,因高温蒸发海水,消耗的能源多,成本太高,故B错误;
C.利用晒盐后的苦卤水,加入沉淀剂,因节约能源,成本低,与选项A相比镁离子浓度高,有利于镁元素的富集,故C正确;
故答案为:C;该方法因Mg2+浓度大,节约能源,成本较低;
III.(1)根据镁离子能与氢氧根离子反应生成沉淀:Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓;
(3)因Mg(OH)2不溶于水,可用过滤的方法进行分离,故答案为:过滤.
②的反应为:Mg(OH)2+2HCl=MgCl2+2H2O,元素的化合价未变,不是氧化还原反应;
③反应为:MgCl2
| ||
故答案为:③;
II.A.直接往海水中加沉淀剂,因海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,故A错误;
B.加热蒸发海水后,加入沉淀剂,因高温蒸发海水,消耗的能源多,成本太高,故B错误;
C.利用晒盐后的苦卤水,加入沉淀剂,因节约能源,成本低,与选项A相比镁离子浓度高,有利于镁元素的富集,故C正确;
故答案为:C;该方法因Mg2+浓度大,节约能源,成本较低;
III.(1)根据镁离子能与氢氧根离子反应生成沉淀:Mg2++2OH-=Mg(OH)2↓,故答案为:Mg2++2OH-=Mg(OH)2↓;
(3)因Mg(OH)2不溶于水,可用过滤的方法进行分离,故答案为:过滤.
点评:本题以海水中提取镁为题材,主要考查硫酸镁、氢氧化镁等物质的性质,掌握物质的化学性质,问题会迎刃而解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

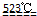 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑