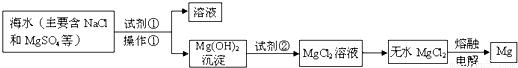
题目内容
镁及其合金是用途广泛的金属材料,目前世界上60%的镁是从海水中提取 的.某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: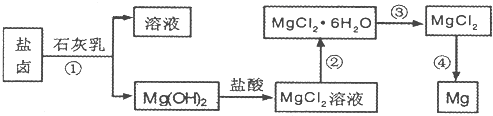
(1)从转化(①得到的Mg( OH)2沉淀中混有少量的Ca( OH)2,除去少量Ca( OH)2的方法是先将沉淀加入到盛有
(2)写出转化④中发生反应的化学方程式
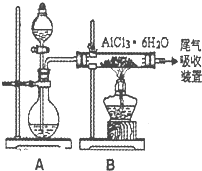
(3)已知转化③的反应原理与制取无水AlCl3相同下图是制取无水AlCl3实验装置图.装置A中的两液体分别是浓硫酸和浓盐酸.请回答:
①D为什么不直接加热来制取无水AlCl3,请用化学方程式表示:
②分液漏斗中应盛装的试剂是
③由分液漏斗向烧瓶中加试剂时应注意的事项是
分析:(1)根据除杂原理来分析;根据分离不溶于水的固体的方法是过滤进行;
(2)根据电解无水氯化镁得到镁和氯气;
(3)①AlCl3的水解,直接加热AlCl3?6H2O,水解彻底生成氢氧化铝,得不到氯化铝,
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中.
(2)根据电解无水氯化镁得到镁和氯气;
(3)①AlCl3的水解,直接加热AlCl3?6H2O,水解彻底生成氢氧化铝,得不到氯化铝,
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中.
解答:解:(1)Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀,在此过程中玻璃棒的作用是搅拌和引流,
故答案为:饱和MgCl2溶液;过滤、洗涤;引流;
(2)电解无水氯化镁得到镁和氯气,方程式为:MgCl2
Mg+Cl2↑,故答案为:MgCl2
Mg+Cl2↑,
(3)①AlCl3的水解,直接加热AlCl3?6H2O,水解彻底生成氢氧化铝,方程式为:AlCl3+3H2O
Al(OH)3+3HCl↑,得不到氯化铝,
故答案为:AlCl3+3H2O
Al(OH)3+3HCl↑;
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发,所以浓盐酸滴加到浓硫酸中有氯化氢气体产生,故答案为:浓盐酸;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中,故答案为:控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中.
故答案为:饱和MgCl2溶液;过滤、洗涤;引流;
(2)电解无水氯化镁得到镁和氯气,方程式为:MgCl2
| ||
| ||
(3)①AlCl3的水解,直接加热AlCl3?6H2O,水解彻底生成氢氧化铝,方程式为:AlCl3+3H2O
| ||
故答案为:AlCl3+3H2O
| ||
②浓硫酸稀释放热,氯化氢具有挥发性,而浓硫酸难挥发,所以浓盐酸滴加到浓硫酸中有氯化氢气体产生,故答案为:浓盐酸;
③为使稀释放出更多的热量,便于氯化氢的挥发,控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中,故答案为:控制分液漏斗活塞,使浓盐酸缓缓加入到浓硫酸中.
点评:本题主要考查了工业生产来提取镁的流程,实验室制氯化氢,掌握原理是解题的关键,难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
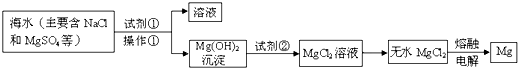
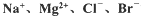 等)中模拟工业生产来提取镁,主要过程如下,回答下列问题:
等)中模拟工业生产来提取镁,主要过程如下,回答下列问题: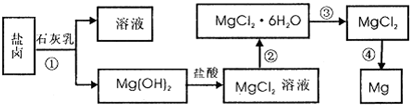
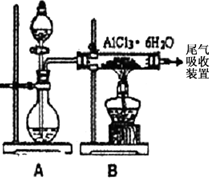

 无水AlCl3实验装置图。装置A中的两液体分别是
无水AlCl3实验装置图。装置A中的两液体分别是