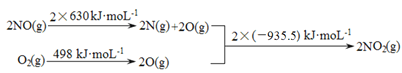
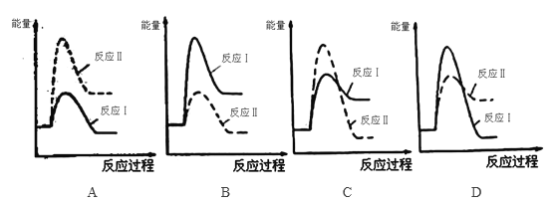
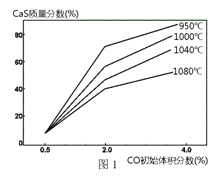
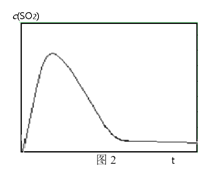
题目内容
【题目】将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
【答案】C
【解析】
试题A、由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故A错误;B、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3时,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故B错误;C、根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO时,转移电子数最少,为0.3mol×![]() ×1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol×
×1=0.15mol,氧化产物只有NaClO3时,转移电子数最多,为0.3mol×![]() ×1=0.25mol,故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;故选C。
×1=0.25mol,故C正确;D、令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,生成NaCl获得的电子为11mol×1=11mol,生成NaClO、NaClO3失去的电子为2mol×1+1mol×5=7mol,得失电子不相等,故D错误;故选C。