题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,可用ClO2为原料制取。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:饱和NaClO2溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时 NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用图所示装置进行实验。
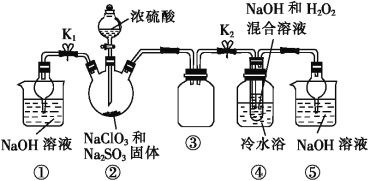
(1)装置①的作用是___________________,装置③的作用是________________。
(2)装置②中制备ClO2的化学方程式为___________________________;装置④中反应生成NaClO2的化学方程式为_____________________。
(3)从装置④反应后的溶液中获得NaClO2晶体的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③__________________;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是______________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是取少量晶体溶于蒸馏水,__________________________________________________________。
(5)为了测定NaClO2粗品的纯度,取10.0 g上述初产品溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1的Na2S2O3标准液滴定,重复2次,平均消耗Na2S2O3溶液20.00 mL,计算得NaClO2粗品的纯度为_____。(提示:2Na2S2O3+I2=Na2S4O6+2NaI)。
【答案】吸收多余的ClO2气体,防止污染环境 防止倒吸(或作安全瓶等) 2NaClO3+Na2SO3+H2SO4(浓)= 2ClO2↑+2Na2SO4+H2O 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 用38~60 ℃的温水洗涤 NaClO3和NaCl 滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4 (2分) 90.5%
【解析】
(1)装置②中产生的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;装置③是安全瓶,可以防止倒吸;综上所述,本题答案是:吸收多余的ClO2气体,防止污染环境; 防止倒吸(或作安全瓶等) 。
(2)亚硫酸钠具有还原性,氯酸钠具有氧化性,在酸性环境下二者发生氧化还原反应生成ClO2,化学方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;在装置④中ClO2得到电子被还原变为NaClO2,H2O2失去电子,表现还原性,反应的化学方程式为2NaOH+2ClO2+H2O2![]() 2NaClO2+2H2O+O2。综上所述,本题答案是:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。
2NaClO2+2H2O+O2。综上所述,本题答案是:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。
(3)从溶液中制取晶体,一般采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法,根据题给信息NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl知,从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃的温水洗涤;④低于60℃干燥,得到成品。如果撤去④中的冷水浴,由于温度高,可能导致NaClO2分解成NaClO3和NaCl,所以产品中混有的杂质是NaClO3和NaCl。综上所述,本题答案是:用38~60 ℃的温水洗涤;NaClO3和NaCl。
(4)检验所得NaClO2晶体是否含有杂质Na2SO4,取少量晶体溶于蒸馏水,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4 ;综上所述,本题答案是:滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4 。
(5) ClO2-+4I-+4H+=Cl-+2I2+2H2O,用Na2S2O3标准液滴定,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI,可得反应的关系式为: ClO2--2I2-4Na2S2O3,又n(Na2S2O3)=0.2 mol·L-1×0.02 L=0.004 mol,得n(ClO2-)=0.001 mol,所以1L溶液中含有:n(NaClO2)=0.001 mol×100=0.1mol,则10.0 g NaClO2粗品中含有:m(NaClO2)=0.1 mol×90.5 g·mol-1=9.05 g,则w(NaClO2)=9.05/10.0×100%=90.5%。综上所述,本题答案是:90.5%。
Na2S4O6+2NaI,可得反应的关系式为: ClO2--2I2-4Na2S2O3,又n(Na2S2O3)=0.2 mol·L-1×0.02 L=0.004 mol,得n(ClO2-)=0.001 mol,所以1L溶液中含有:n(NaClO2)=0.001 mol×100=0.1mol,则10.0 g NaClO2粗品中含有:m(NaClO2)=0.1 mol×90.5 g·mol-1=9.05 g,则w(NaClO2)=9.05/10.0×100%=90.5%。综上所述,本题答案是:90.5%。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】将足量的新制氯水分别滴加到下列溶液或滤纸上,对所观察到的现象描述合理的一组是
AgNO3溶液 | 蓝色石蕊试纸 | Na2CO3溶液 | |
A | 产生沉淀 | 变红后无现象 | 有气泡 |
B | 无明显现象 | 变红后无现象 | 产生沉淀 |
C | 产生沉淀 | 先变红后褪色 | 有气泡 |
D | 产生沉淀 | 先变红后褪色 | 产生沉淀 |
A.AB.BC.CD.D
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
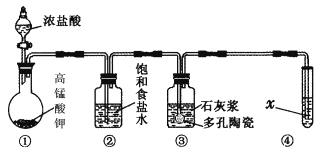
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。
