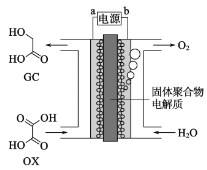
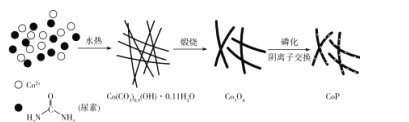
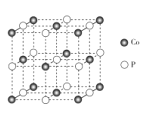
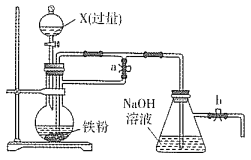
��Ŀ����
����Ŀ����������Ũ�Ⱦ�Ϊ0.5mol/L��������Һ����Na2CO3����NaHCO3����HCl����NH3��H2O��
��1��������Һ�У��ɷ���ˮ�����________(����ţ���ͬ)��
��2��������Һ�У��������������Ʒ�Ӧ�����ܺ����ᷴӦ�����ӷ���ʽ�ֱ�Ϊ________________�� ___________
��3������Һ���м��������Ȼ�粒��壬��ʱ![]() ��ֵ________(������С������)��
��ֵ________(������С������)��
��4�������ۺܵ͢���Һ��Ϻ���Һǡ�ó����ԣ�����ǰ�۵����___�ܵ����(����ڡ�С�ڡ�����)
��5��ȡ10mL��Һ�ۣ���ˮϡ�͵�500mL�������Һ����ˮ�������c(H��)��________��
���𰸡��٢� HCO3-+OH-=H2O+CO32- HCO3-+H+=H2O+ CO2 ���� С�� 1012
��������
(1)���������ӵ����ܷ���ˮ�⣬�ݴ˷�����
(2)�⼸�������У��ܺ�ǿ�ǿ�ᷴӦ������Ϊ�������ʽ�Σ��ݴ˷�����
(3)��ˮ�м����Ȼ������һˮ�ϰ����룬�ݴ˷�����
(4)NH3H2OΪ������ʣ�������ȫ���룬�ݴ˷�����
(5)ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����ʮ��֮һ��Ϊ0.01mol/L���ݴ˷�����
(1)���������ӵ����ܷ���ˮ�⣬Na2CO3��NaHCO3���Ǻ��������ӵ��Σ��ܷ���ˮ�⣬�ʴ�Ϊ���٢ڣ�
(2) �⼸�������У��ܺ�ǿ�ǿ�ᷴӦ��������̼�����ƣ���Ӧ�����ӷ���ʽ�ֱ�ΪHCO3-+ OH-=H2O+ CO32-��HCO3-+H+=H2O+ CO2���ʴ�Ϊ��HCO3-+OH-=H2O+CO32-��HCO3-+H+=H2O+ CO2��
(3) ��ˮ�м����Ȼ�泥���Һ��笠�����Ũ����������һˮ�ϰ����룬����������Ũ�ȼ�С������c(NH4+)c(OH)��ֵ���ʴ�Ϊ������
(4) NH3H2OΪ������ʣ�������ȫ���룬��������ϣ���Һ�����ԣ�Ҫ������ˮӦ�������ʴ�Ϊ��С�ڣ�
(5) ȡ10mL��Һ�ۣ���ˮϡ�͵�100mL����ҺŨ��Ϊԭ����![]() ��Ϊ0.01mol/L����Kw=c(OH)c(H+)��֪��c(OH)=1012molL1�����ʱ��Һ����ˮ�������c(H+)=1012molL1���ʴ�Ϊ��1012��
��Ϊ0.01mol/L����Kw=c(OH)c(H+)��֪��c(OH)=1012molL1�����ʱ��Һ����ˮ�������c(H+)=1012molL1���ʴ�Ϊ��1012��