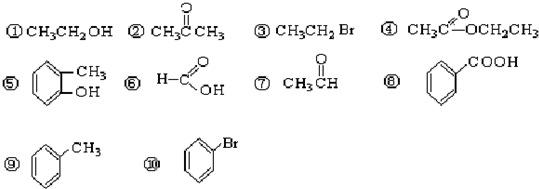
题目内容
15.某草酸亚铁样品(FeC2O4•xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:5Fe2++5C2O42-+3MnO4-+24H+═5Fe3++10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后,继续用0.02000mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为cmL
③重复以上实验1-2次.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是重复以上实验1-2次.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ.检验活塞是否漏水.
Ⅱ.用高锰酸钾标准溶液润洗滴定管.
Ⅲ.加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有KSCN溶液的试管中,如溶液中没有出现血红色(或红色),则说明溶液合格.
(4)某小组的一次测定数据记录如表:
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
分析 (1)为了减小误差,需要重新操作实验;
(2)Ⅱ.用高锰酸钾标准溶液润洗滴定管;
(3)可以根据检验三价铁离子的方法完成;
(4)根据表中数据,舍弃无效数据,然后计算出消耗高锰酸钾溶液的平均体积,根据关系式计算出亚铁离子、草酸根离子的浓度,再根据亚铁离子、草酸根离子的物质的量计算出草酸铁的质量分数.
解答 解:(1)为了使实验数据更加准确,需要重复1-2次实验,
故答案为:重复以上实验1-2次;
(2)Ⅱ.用高锰酸钾标准溶液润洗滴定管,
故答案为:用高锰酸钾标准溶液润洗滴定管;
(3)要证明溶液中没有三价铁离子,可以向溶液中加入硫氰化钾溶液,溶液中没有出现血红色,证明溶液中没有三价铁离子,
故答案为:KSCN;溶液中没有出现血红色(或红色);
(4)由于第三次试验的数据误差较大,舍弃掉,
样品配制溶液中亚铁离子、草酸根离子消耗的高锰酸钾溶液的体积为:42.40ml,高锰酸钾的物质的量为:0.0424L×0.02000mol/L=8.48×10-4mol,
亚铁离子消耗的高锰酸钾溶液的平均体积为:42.40mL-31.30mL=11.10mL,高锰酸钾的物质的量为:0.0111L×0.02000mol/L=2.22×10-4mol,
草酸根离子消耗的高锰酸钾溶液的体积为:31.30mL-11.10mL=20.20mL,高锰酸钾的物质的量为:0.02020L×0.02000mol/L=4.04×10-4mol
根据化合价升降相等找出关系式:5Fe2+~MnO4-,5C2O42-~2MnO4-,
n(Fe2+)=5×2.22×10-4mol=0.001110mol,
n(C2O42-)=2.5×4.04×10-4mol=0.001010mol,
根据草酸根离子物质的量可知草酸铁的物质的量为:0.00101mol,质量为:0.00101mol×144=0.14544g,
草酸铁的质量分数为:$\frac{0.14544g}{0.1970g}$×100%≈73.81%,
故答案为:0.001110mol; 0.001010mol;73.81%.
点评 本题考查了用滴定法测定该样品中FeC2O4的含量,涉及了实验方案设计、滴定管的使用、质量分数的计算等知识,可以根据所学知识完成,难度中等.

| A. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O 氧化反应 | |
| B. | 苯中加入溴水,充分振荡静置,溴水褪色 取代反应 | |
| C. | nCH2═CHCl$\stackrel{催化剂}{→}$ 加聚反应 加聚反应 | |
| D. | CH2═CH2+Br2→CH2BrCH2Br 加成反应 |
| A. | 将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| B. | 不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 | |
| C. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| D. | 定容时俯视容量瓶的刻度线会导致所配制的溶液浓度偏低 |
| A. | BaCl2 | B. | 溴水 | C. | 稀盐酸 | D. | 品红溶液 |
C(石墨)+$\frac{1}{2}$O2(g)═CO(g)△H=-111kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol
C(石墨)+O2(g)═CO2(g)△H=-394kJ/mol
则25℃时1mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为( )
| A. | +41.kJ/mol | B. | -41kJ/mol | C. | 283kJ/mol | D. | -131kJ/mol |
| A. | 拨打火警电话119 | B. | 用湿抹布扑盖 | ||
| C. | 找老师一起想办法 | D. | 逃跑 |
| A. | 甲烷 | B. | 乙烷 | C. | 水 | D. | 氧气. |